ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
Вправа 1 Серед наведених у підручнику сполук у підручнику
ізомери: А 1, 4, 5; Б 1, 2 , 3
гомологи: В 2, 3, 5; Г 1,4.
Відповідь: ізомери А, гомологи В
Запишемо молекулярні формули запропонованих речовин:
1) C5H8 2) C3H4 3) C2H2 4) C5H8 5) C5H8
Ізомери — речовини, які мають однаковий якісний і кількісний склад молекул (молекулярну формулу), але різну будову (структурну формулу), тому ізомерами будуть речовини 1), 4), 5)
Гомологи — речовини, які мають схожу будову, але відрізняються на одну чи декілька груп атомів СН2 — гомологічну різницю, тому гомологами є речовини 2), 3), 5) :
Вправа 2 Складіть рівняння реакції приєднання двох молекул гідроген галогеніду до молекули етину.
CH≡CH + 2HCl -> CH3—CHCl2
Вправа 3 На якій хімічній властивості етину ґрунтується його застосування для зварювання металів? При його горінні в чистому кисні температура полум’я сягає 3000°С
Вправа 4 Укажіть правильне твердження.
А кальцій карбід пахне ацетиленом
Б алкіни горять кіптявим полум’ям
В алкіни й алкени — ізомери
Г алкіни — насичені вуглеводні
Відповідь: Б
Додаткові завдання
Вправа 1 Порівняйте будову молекул етену й етину.
У молекулі етену С2Н4 подвійний зв'язок С=С зумовлений двома спільними електронними парами, утвореними за участю двох електронів кожного атома Карбону, а простий ковалентний зв’язок С–Н — електронною парою, спільною для атомів Карбону і Гідрогену. Усі атоми молекули перебувають на одній площині, а кути між лініями, що з’єднують центри атомів, становлять 120°:
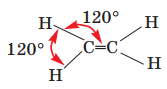
У молекулі етину С2Н2 потрійний зв’язок С≡С зумовлений трьома спільними електронними парами, утвореними за участю трьох електронів кожного атома Карбону, а простий ковалентний зв’язок С–Н — електронною парою, спільною для атомів Карбону і Гідрогену. Центри всіх атомів молекули перебувають на прямій лінії:
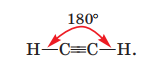
Вправа 2 Наведіть структурні формули й назви ізомерів складу С6Н10.
|
1) СН≡С—СН2—СН2—СН2—СН3 гекс-1-ин |
|
2) CН≡С—СН—СH2—СН3 3-метилпент-1-ин | СН3 |
|
3) CН≡С—СН2—СH—СН3 4-метилпент-1-ин | СН3 |
|
СН3 | 4) CН≡С—С—СН3 3,3-диметилбут-1-ин | СН3 |
|
5) СН3—С≡С—СН2—СН2—СН3 гекс-2-ин |
|
6) CН3—С≡С—СH—СН3 4-метилпент-2-ин | СН3 |
|
7) СН3—С2—С≡С—СН2—СН3 гекс-3-ин |
Вправа 3 Чим різняться між собою реакції приєднання в алкенів і алкінів? Молекула алкена здатна приєднати одну молекулу водню, галогену, галогеноводню, а молекула алкіна — дві молекули цих сполук
Наведіть приклади.
CH2=CH2 + H2 -> CH3—CH3
CH≡CH + 2H2 -> CH3—CH3
CH2=CH2 + Br2 -> CH2Br—CH2Br
CH≡CH + 2Br2 -> CHBr2—CHBr2
CH2=CH2 + HBr -> CH3—CH2Br
CH≡CH + 2HBr -> CH3—CHBr2
Вправа 4 Обґрунтуйте галузі застосування ацетилену його хімічними властивостями. Завдяки високій температурі полум'я згоряння ацетилен використовують для газового різання і зварювання металів. З ацетилену добувають вихідні речовини для виготовлення пластмас (хлорвініл Н2С=СНСl, вінілацетат Н2С=СН—ОСОСН3) та каучуків (вінілацетилен НС≡С—СН=СН2)
Вправа 5 Схарактеризуйте способи добування ацетилену з погляду їх економічності.
Енергоємним є карбідний спосіб добування ацетилену:
CaC2 + 2H2O -> C2H2 + Ca(OH)2
Економічно вигідніше добувати ацетилен з метану нагріванням його до температури 1500 °С — піролізом:
2СН4 -> Н—С≡С—Н + 3Н2
Вправа 6 Для добування етину піролізом метану використали природний газ, що містить 8% домішок, об’ємом 48,7 л. Якого об’єму етин добуто?
Відомо: V(СН4 із дом.)=48,7 л, φ(дом.)=8%
Знайти: V(С2H2)-?
Розв'язування
І спосіб
1. Знаходимо об'єм основної речовини (чистого метану) в природному газі.
φ(СH4)=100%-φ(дом.)=100% - 8%=92%
V(CH4)=φ(CH4)•V(CH4 із дом.):100%=92%•48,7 л:100%=44,804 л
2. Записуємо рівняння реакції:
44,804 л х л
2CH4 → C2H2 + 2H2↑
44,8 л 22,4 л
За н.у. 1 моль газу займає 22,4 л, а 2 моль займуть удвічі більший об'єм, тобто 44,8 л
х=V(С2H2)=44,804 л • 22,4 л : 44,8 л=22,4 л
ІІ спосіб
1. Знаходимо об'єм основної речовини (чистого метану) в природному газі.
V(дом.)=φ(дом.)•V(CH4 із дом.):100%=8%•48,7 л:100%=3,896 л
V(CH4)=V(CH4 із дом.)-V(дом.)=48,7 л - 3,896 л=44,804 л
2. Обчислюємо кількість речовини метану:
n(СН4)=m(СН4):M(СН4)=44,804 л : 22,4 л/моль=2 моль
3. Записуємо рівняння реакції: 2CH4 → C2H2 + 2H2↑
За рівнянням реакції n(СН4):n(С2Н2)=2:1, тому
n(С2H2)=n(СН4):2=2 моль:2=1 моль
V(С2H2)=n(С2H2)•VM=1 моль•22,4 л/моль=22,4 л
Відповідь: 22,4 л