ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
Вправа 1 Чому структуру бензену було з’ясовано лише через 40 років після його відкриття? Бо жодна із пропонованих структурних формул не відповідала властивостям речовини, що спостерігалися вченими в лабораторії
Вправа 2 За хімічними властивостями бензен не належить ні до насичених, ні до ненасичених вуглеводнів. Чому? У молекулі бензену між атомами Карбону немає звичайних простих і кратних зв’язків, а є замкнена електронна система, утворена р-електронами, яку схематично позначають кільцем усередині шестикутника.
Вправа 3 На мал. 17 зображено полум’я бензену, метану й етену. Яке зображення відповідає кожній з речовин? Відповідь: перше зліва відповідає бензену, друге ― етену, третє ― метану
Відповідь поясніть. Характер горіння сполук залежить від їхнього складу. Чим вищою є масова частка Карбону у сполуці, тим більшою кіптявою супроводжується горіння
Вправа 4 Чи знебарвлює бензен бромну воду? Ні, не знебарвлює
Поясніть, чому. У молекулі бензену відсутні кратні зв'язки
Вправа 5 Які реакції характерні для бензену? Бензену властиві реакції заміщення; за певних умов він вступає в реакції приєднання
Складіть рівняння реакцій.
Реакції заміщення:
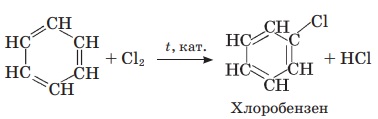
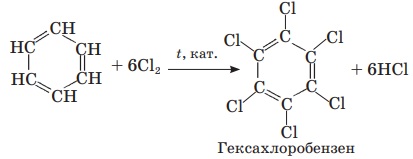
Реакції приєднання:
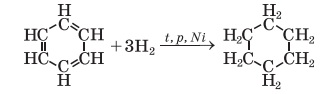
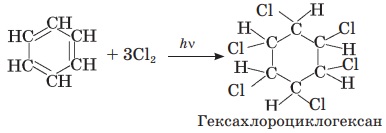
Вправа 6 Які з наведених сполук належать до насичених, ненасичених, ароматичних: С6Н12, С6Н6, С6Н5Сl, С6Н14?
Відповідь: С6Н14―насичені, С6Н12―ненасичені, С6Н6 і С6Н5Сl―ароматичні
Додаткові завдання
Вправа 1 Поясніть умовність формули Кекуле для бензену. Ця формула не повністю відповідає хімічним властивостям бензену, бо не пояснює, чому бензен, маючи кратні зв’язки, за звичайних умов не вступає у реакції приєднання
Вправа 2 Поясніть вплив умов на перебіг реакції бензену з хлором. До молекули бензену, активованої дією ультрафіолетового випромінювання, можуть приєднатися три молекули хлору, при цьому утворюється гексахлороциклогексан. Галогенування бензену за типом заміщення відбувається під дією каталізатора, при цьому можуть заміщуватися усі шість атомів Гідрогену з утворенням гексахлоробензену
Вправа 3 Зробіть висновок про реакційну здатність бензену порівняно з насиченими і ненасиченими вуглеводнями. Реакційна здатність бензену вища, ніж насичених вуглеводнів, але нижча, ніж ненасичених
Вправа 4 Складіть рівняння послідовних перетворень: вугілля на бензен; метану на хлоробензен.
|
вугілля на бензен
|
метану на хлоробензен
|
|
С + H2 → CH4 (Pt, to) 2CH4 → C2H2 + 3H2 (to) 3C2H2 → C6H6 |
2CH4 → C2H2 + 3H2 (to) 3C2H2 → C6H6 C6H6 + Cl2 → C6H5Cl + HCl (кат.) |
А 22,4 л
Б 67,2 л
В 44,8 л
Г 11,2 л
Відповідь: В
Відомо: m(С6H5Cl)=225 г
Знайти V(Сl2)-?
Розв'язування
І спосіб
1. Записуємо рівняння реакції.
х л 225 г
С6Н6 + Сl2 → C6H5Cl + HCl
22,4 л 112,5 г
Над формулами речовин записуємо дані, що є за умовою задачі.
Прореагувало 1 моль хлору Cl2 (1 моль газу за н.у. займає об'єм 22,4 л) з утворенням 1 моль хлоробензену C6H5Cl. Обчислюємо молярну масу (M=Mr г/моль) хлоробензену й, відповідно, масу 1 моль
M(C6H5Cl)=112,5 г/моль, маса 1 моль=112,5 г
Відповідні значення записуємо під формулами речовин у рівнянні реакції.
За допомогою пропорції обчислюємо об'єм хлору.
х л / 22,4 л = 225 г / 112,5 г, звідси
х л • 112,5 г = 22,4 л • 225 г
х=V(Cl2)=22,4 л • 225 г : 112,5 г=44,8 л
ІІ спосіб
1. Обчислюємо кількість речовини хлоробензену масою 225 г.
M(C6H5Cl)=112,5 г/моль, маса 1 моль=112,5 г
ν(С6H5Cl)=m(C6H5Cl):M(C6H5Cl)=225 г : 112,5 г/моль=2 моль
2. Записуємо рівняння реакції: С6Н6 + Сl2 → C6H5Cl + HCl
За рівнянням реакції v(Cl2):v(C6H5Cl)=1:1, тому
v(Cl2)=v(C6H5Cl)=2 моль
3. Обчислюємо об'єм хлору кількістю речовини 2 моль:
V((Cl2)=v(Cl2)•VM=2 моль•22,4 л/моль=44,8 л
Відповідь: 44,8 л