Другие задания смотри здесь...
![]()
Упражнение 115 Как вычислить массовую долю элемента в соединении, если известны:
а) масса элемента и соответствующая масса соединения;
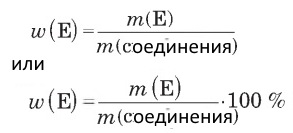
w(E) — массовая доля элемента в веществе,
m(E) — масса элемента в веществе,
m(соединения) — масса соединения.
б) химическая формула соединения?
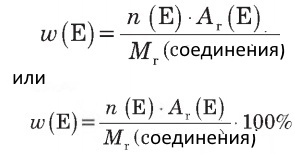
n(Е) — количество атомов химического элемента Е в молекуле или формульной единице,
Аr(Е) — относительная атомная масса элемента,
Мr(соединения) — относительная молекулярная (или формульная) масса химического вещества.
Упражнение 116 Какова массовая доля элемента в простом веществе?
Равна 1 или 100%
Упражнение 117 В 20 г вещества содержится 16 г Брома. Найдите массовую долю этого элемента в веществе, выразив ее обычной дробью, десятичной дробью и в процентах.
Дано: m(вещества)=20 г, m(Br2)=16 г
Найти: w(Br)-?
Решение
w(Br)=m(Br2)/m(вещества)=16 г / 20 г=4/5=0,8, или 80%
Ответ: 4/5, или 0,8, или 80%
Упражнение 118 Рассчитайте (желательно устно) массовые доли элементов в соединениях, имеющих такие формулы:
а) SO2
Mr(SO2)=Ar(S)+2•Ar(O)=32+2•16=64
w(S)=Ar(S)/Mr(SO2)=32:64=0,5, или 50%
w(О)=2•Ar(O)/Mr(SO2)=2•16:64=0,5, или 50%
Другой вариант расчета массовой доли Оксигена:
w(O)=1-w(S)=1-0,5=0,5
или
w(O)=100%-w(S)=100%-50%=50%
Ответ: w(S)=0,5, или 50%; w(O)=0,5, или 50%
б) SiH4
Mr(SіН4)=Ar(Sі)+4•Ar(Н)=28+4•1=32
w(Sі)=Ar(Sі)/Mr(SіН4)=28:32=0,875, или 87,5%
w(Н)=100%-w(Si)=100%-87,5%=12,5%
Ответ: w(Sі)=87,5%, w(Н)=12,5%
в) CrO3.
Mr(CrO2)=Ar(Cr)+2•Ar(O)=52+2•16=84
w(Cr)=Ar(Cr)/Mr(CrO2)=52:84=0,62, или 62%
w(О)=100%-w(Cr)=100%-62%=38%
Ответ: w(Cr)=62%, w(Н)=38%
Упражнение 119 Выполните необходимые вычисления для уксусной кислоты СН3СООН и глицерина С3Н5(ОН)3 и заполните таблицу:
|
Формула соединения |
Mr (соеди- нения) |
w(С) | w(Н) | w(O) |
| СН3СООН | 60 |
40% |
7% |
53% |
| С3Н5(ОН)3 | 92 |
39% |
9% |
52% |
Для СН3СООН:
Mr(СН3СООН)=2•Ar(C)+4•Ar(Н)+2•Ar(O)=2•12+4•1+2•16=60
w(C)=2•Ar(C)/Mr(СН3СООН)=2•12:60=0,4, или 40%
w(О)=2•Ar(O)/Mr(СН3СООН)=2•16:60=0,53, или 53%
w(Н)=100%-w(C)-w(O)=100%-40%-53%=7%
Для С3Н5(ОН)3:
Mr(С3Н5(ОН)3)=3•Ar(C)+8•Ar(Н)+3•Ar(O)=2•12+4•1+2•16=92
w(C)=3•Ar(C)/Mr(С3Н5(ОН)3)=3•12:92=0,39, или 39%
w(О)=3•Ar(O)/Mr(С3Н5(ОН)3)=3•16:92=0,52, или 52%
w(Н)=100%-w(c)-w(O)=100%-39%-52%=9%
Упражнение 120 Сопоставляя формулы веществ, а также значения относительных атомных масс, определите, в каком из веществ каждой пары массовая доля первого в формуле элемента больше:
а) N2O, NO
Mассовая доля Нитрогена в первом соединении больше, ибо в формуле N2О на один атом Оксигена приходится два атома Нитрогена, а в формуле NO ― один атом Нитрогена.
Ar(N)=14; Ar(O)=16
Mr(N2О)=2•Ar(N)+Ar(O)=2•14+16=44
w(N)=2•Ar(N)/Mr(N2О)=2•14:44=0,63, или 63%
Mr(NО)=Ar(N)+Ar(O)=14+16=30
w(N)=Ar(N)/Mr(NО)=14:30=0,46, или 46%
б) СО, СО2
Mассовая доля Карбона в первом соединении больше, ибо в формуле СО на один атом Карбона приходится один атом Оксигена, а в формуле СO2 ― два атома Оксигена.
Ar(С)=12; Ar(O)=16
Mr(СО)=Ar(С)+Ar(O)=12+16=28
w(С)=Ar(С)/Mr(СО)=12:28=0,42, или 42%
Mr(СО2)=Ar(С)+2•Ar(О)=12+2•16=44
w(С)=Ar(С)/Mr(СО2)=12:44=0,27, или 27%
в) В2O3, В2S3
Оба вещества содержат одинаковое количество атомов Бора, но
Mr(B2О3)<Mr(B2S3), ибо Ar(О)<Ar(S), поэтому массовая доля Бора в первом соединении больше.
Ar(В)=11; Ar(O)=16; Ar(S)=32
Mr(B2О3)=2•Ar(B)+3•Ar(O)=2•11+3•16=70
w(B)=2•Ar(B)/Mr(B2О3)=2•11:70=0,31, или 31%
Mr(B2S3)=2•Ar(B)+3•Ar(S)=2•11+3•32=118
w(B)=2•Ar(B)/Mr(B2S3)=2•11:118=0,19, или 19%
Изменения в издании 2020 года. г) PbO, PbO2, Pb3O5
Mасcовая доля Плюмбума в первой соединении больше, потому что в формуле PbO на один атом Плюмбума приходится один атом Оксигена, а в формуле PbO2 ― два атома Оксигена. Mr(PbО)<Mr(Pb3O4) и Ar(Pb)<3•Ar(Pb), поэтому массовая доля Плюмбума в первом соединении является наибольшей.
Ar(Pb)=207; Ar(O)=16
Mr(PbО)=Ar(Pb)+Ar(O)=207+16=223
w1(Pb)=Ar(Pb)/Mr(PbО)=207:223=0,93, или 93%
Mr(PbO2)=Ar(Pb)+2•Ar(O)=207+2•16=239
w2(Pb)=Ar(Pb)/Mr(PbO2)=207:239=0,87, или 87%
Mr(Pb3O4)=3•Ar(Pb)+4•Ar(Pb)=3•207+4•16=685
w3(Pb)=3•Ar(Pb)/Mr(Pb3O4)=3•207:685=0,91, или 91%
Упражнение 121 Массовая доля Кальция в его соединении с Гидрогеном равна 0,952. Какие массы Кальция и Гидрогена содержатся в 20 г соединения?
Дано: w(Са)=0,952, m(соединения)=20 г
Найти: m(Н)-?
Решение
І способ
Вычисляем массу Кальция:
m(Са)=w(Са)•m(соединения)=0,925•20 г=19,04 г
Вычисляем массу Гидрогена:
m(Н)=m(соединения)-m(Ca)=20 г - 19,04 г=0,96 г
ІІ способ
Вычисляем массу Кальция:
m(Са)=w(Са)•m(соединения)=0,925•20 г=19,04 г
Вычисляем массовую долю Гидрогена в соединении:
w(Н)=1 - w(Са)=1-0,952=0,048
Вычисляем массу Гидрогена:
m(Н)=w(Н)•m(соединения)=0,048•20 г=0,96 г
Ответ: 19,04 Кальция и 0,96 г Гидрогена
Упражнение 122 Массовая доля Нитрогена в соединении равна 28%. В какой массе соединения содержится 56 г Нитрогена?
Дано: w(N)=28%, или 0,28; m(N)=56 г
Найти: m(соединения)-?
Решение
І способ
С формулы вычисления массовой доли Нитрогена в соединении находим массу соединения:
m(соединения)=m(N):w(N)=56 г:0,28=200 г
ІІ способ
Для определения массы соединения составляем пропорцию и решаем её:
То, что массовая доля Нитрогена равна 28% значит, что
в 100 г соединения содержится 28 г Нитрогена,
в х г соединения ― 56 г Нитрогена.
100 г / х г = 28 г / 56 г, по свойству пропорции
х г • 28 г = 56 г • 100 г, отсюда
х = 56 г • 100 г : 28 г= 200 г
Ответ: 200 г
Упражнение 123 Найдите количество атомов Оксигена в молекуле SOx, если массовая доля этого элемента в соответствующем соединении равна 0,6.
Дано: соединение SOx, w(О)=0,6
Найти: x-?
Решение
І способ
Находим массовую долю Сульфура в соединении:
w(S)=1-w(O)=1-0,6=0,4
Находим соотношение атомов Сульфура и Оксигена в соединении как деление численных значений массовых долей химических элементов, входящих в состав соединения, на их относительные атомные массы:
w(S)/Ar(S) : w(O)/Ar(O)=0,4/32 : 0,6/16=0,0125:0,0375=1:3
С вычисления видно, что в соединении на один атом Сульфура приходится три атома Оксигена.
ІI способ
Ar(S)=32, Ar(O)=16, Mr(SOx)=Ar(S)+x•Ar(O)=32+16x
С формулы вычисления массовой доли Оксигена в соединении находим число атомов Оксигена:
х=w(O)•M(SOx):Ar(O)
x=0,6(32+16x):16
16x=0,6(32+16x)
16x=19,2+9,6x
16x-9,6x=19,2
6,4x=19,2
x=19,2:6,4
x=3
Ответ: 3 атома Оксигена
Для тех, кто хочет знать больше. Покажем, почему отношение количества атомов находят как деление числовых значений массовых долей химических элементов, входящих в состав данного соединения, на их относительные атомные массы:
С формул вычисления массовых долей элементов в соединении:
w(элемента1)=х•Ar(элемента1)/Mr(соединения) и
w(элемента2)=y•Ar(элемента2)/Mr(соединения),
виразим количество атомов:
x=(w(элемента1)•Mr(соединение))/Ar(элемента1) и
y=(w(элемента2)•Mr(соединения))/Ar(элемента2)
и вычислим их соотношения:
x:y=w(элемента1)/Ar(элемента1):w(элемента2)/Ar(элемента2)
Упражнение 124 Массовая доля Феррума в образце соединения FeO равна 75%. С помощью вычислений выясните, является ли этот образец чистым соединением.
Дано: w(Fe)=75%
Найти: образец чистое соединение-?
Решение
Mr(FeO)=Ar(Fe)+Ar(O)=56+16=72
w(Fe)=Ar(Fe)/Mr(FeO)=56:72=0,78, или 78%
То, что массовая доля элемента в соединении составляет 78% означает, что в 100 г соединения содержится 78 г Феррума. По условию задачи в 100 г соединения содержится 75 г Феррума, значит его меньше, чем должно быть, поэтому образец не является чистым соединением.
Ответ: образец с примесями