Другие задания смотри здесь...
![]()
Контрольные вопросы
Вопрос 1 Дайте определения понятиям «относительная атомная масса» и «относительная молекулярная масса».
Относительная атомная масса — это отношение массы атома данного элемента к 1/12 массы атома Карбона.
Относительная молекулярная масса Мr показывает, во сколько раз масса молекулы больше 1/12 массы атома Карбона.
Что в данном случае означает слово «относительная»?
Определенная сравнением с другой величиной — эталоном. Эталоном атомных и молекулярных масс является атомная единица массы (1а.е.м.=1,66•10-24г).
Вопрос 2 Для каких веществ используют термин «молекулярная масса», а для каких — «формульная масса»? Для веществ молекулярного строения используют термин «молекулярная масса», а для веществ немолекулярного (ионного и атомного) строения — «формульная масса».
Вопрос 3 Как определяют относительную молекулярную массу?
Относительная молекулярная масса равна сумме относительных атомных масс всех химических элементов, которые входят в состав молекулы, с учетом числа атомов каждого элемента.
Для определения относительной молекулярной массы вещества с формулой EхDу необходимо относительные атомные массы элементов E и D умножить на число их атомов, соответственно на х и у, и затем сложить: Mr(ExDy)=x●Ar(E)+y●Ar(D)
Вопрос 4 Дайте определения массовой доли элемента в веществе и массовой доли растворенного вещества. Приведите формулы для их вычисления.
Массовая доля элемента (w) показывает, какая часть массы вещества приходится на атомы данного элемента. Ее вычисляют как отношение относительной атомной массы данного элемента с учетом числа его атомов в молекуле к относительной молекулярной (формульной) массе вещества:
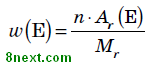
где w(E) — массовая доля химического элемента E, выраженная в долях единицы;
n — число атомов элемента E, обозначенное индексом в формуле соединения;
Ar — относительная атомная масса элемента E;
Mr — относительная молекулярная (формульная) масса вещества.
Массовая доля вещества в растворе показывает, какая часть массы раствора приходится на растворенное вещество. Массовую долю растворенного вещества вычисляют по формуле:
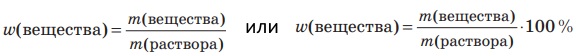
Задания для усвоения материала
Упражнение 1 Вычислите относительные молекулярные (формульные) массы веществ: хлор Cl2, сульфатная кислота H2SO4, сахароза C12H22O11, гидроген пероксид (перекись водорода) H2O2, мел CaCO3, малахит (CuOH)2CO3.
Mr(Cl2)=2•Ar(Cl)=2•35,5=71
Mr(H2SO4)=2•Ar(H)+Ar(S)+4•Ar(O)=2•1+32+4•16=98
Mr(C12H22O11)=12•Ar(C)+22•Ar(H)+11•Ar(O)=12•12+22•1+11•16=342
Mr(CaSO4)=Ar(Ca)+Ar(S)+4•Ar(O)=40+32+4•16=136
Mr(H2O2)=2•Ar(H)+2•Ar(O)=2•1+2•16=34
Mr(CaCO3)=Ar(Ca)+Ar(C)+3•Ar(O)=40+12+3•16=100
Mr((CuOH)2CO3)=2•Ar(Cu)+2•Ar(H)+Ar(C)+5•Ar(O)=2•64+2•1+12+5•16=222
Упражнение 2 Вычислите массовые доли всех элементов в соединениях с такими химическими формулами:
a) NO2
Mr(NO2)=Ar(N)+2•Ar(O)=14+2•16=46
w(N)=Ar(N)/Mr(NO2)=14:46=0,304, или 30,4%
Массову долю Оксигена можно найти так:
w(О)=100%-w(N)=100%-30,4%=69,6%
или так:
w(О)=1-w(N)=1-0,304=0,696
либо так:
w(О)=2•Ar(О)/Mr(NO2)=2•16:46=0,696, или 69,6%
Ответ: w(N)=0,304, или 30,4%; w(О)=0,696, или 69,6%
6) РbСl2
Mr(PbCl2)=Ar(Pb)+2•Ar(Cl)=207+2•35,5=278
w(Pb)=Ar(Pb)/Mr(PbCl2)=207:278=0,745, или 74,5%
w(Cl)=100%-w(Pb)=100%-74,5%=25,5%
Ответ: w(Pb)=74,5%, w(Cl)=25,5%
в) Na2CO3
Mr(Na2CO3)=2•Ar(Na)+Ar(C)+3•Ar(O)=2•23+12+3•16=106
w(Na)=2•Ar(Na)/Mr(Na2CO3)=2•23:106=0,434, или 43,4%
w(C)=Ar(C)/Mr(Na2CO3)=12:106=0,113, или 11,3%
w(O)=100%-w(Na)-w(C)=100%-43,4%-11,3%=45,3%
Ответ: w(Na)=43,4%, w(C)=11,3%, w(O)=45,3%
г) H2SO4
Mr(H2SO4)=2•Ar(H)+Ar(S)+4•Ar(O)=2•1+32+4•16=98
w(H)=2•Ar(H)/Mr(H2SO4)=2•1:98=0,02, или 2%
w(S)=Ar(S)/Mr(H2SO4)=32:98=0,327, или 32,7%
w(O)=100%-w(H)-w(S)=100%-2%-32,7%=65,3%
Ответ: w(H)=2%, w(S)=32,7%, w(O)=65,3%
д) Ва3(РO4)2
Mr(Ba3(PO4)2)=3•Ar(Ba)+2•Ar(P)+8•Ar(O)=3•137+2•31+8•16=601
w(Ba)=3•Ar(Ba)/Mr(Ba3(PO4)2)=3•137:601=0,684, или 68,4%
w(P)=2•Ar(P)/Mr(Ba2(PO4)2)=2•31:601=0,103, или 10,3%
w(O)=100%-w(Ba)-w(P)=100%-68,4%-10,3%=21,3%
Ответ: w(Ba)=68,4%, w(P)=10,3%, w(O)=21,3%
Упражнение 3 В растворе массой 120 г содержится глюкоза массой 3 г. Определите массовую долю растворенного вещества.
Дано: m(раствора)=120 г, m(глюкозы)=3 г
Найти: w(глюкозы)-?
І способ
w(глюкозы)=m(глюкозы)/m(раствора)=3 г:120 г=0,025, или 2,5%
ІІ способ
Определяем массу вещества, содержащегося в 100 г раствора, то есть массовую долю. Для этого составляем пропорцию и решаем ее:
в 120 г раствора содержится 3 г вещества, а
в 100 г раствора ― х г вещества
120 г / 100 г = 3 г / х г, отсюда по свойству пропорции
х г • 120 г = 3 г • 100 г
х=3 г • 100 г : 120 г=2,5 г, поэтому w(глюкозы)=2,5%
Ответ: w(глюкозы)=2,5%
Упражнение 4 Вычислите массу соли, оставшуюся при выпаривании воды из раствора массой 150 г, в котором массовая доля соли составляет 5%.
Дано: m(раствора)=150 г, w(соли)=5%
Найти: m(соли)-?
І способ
С формулы вычисления массовой доли w(соли)=(m(соли)/m(раствора))•100% находим
m(соли)=w(соли)•m(раствора):100%=5%•150 г:100%=7,5 г
ІІ способ
Массовая доля вещества в растворе показывает массу растворенного вещества, содержащегося в 100 г раствора, поэтому для определения массы вещества во всем растворе составляем пропорцию и решаем ее:
в 100 г раствора содержится 5 г соли, а
в 150 г раствора ― х г соли
100 г / 150 г = 5 г / х г, отсюда по свойству пропорции
тому х г • 100 г = 5 г • 150 г
х=5 г • 150 г : 100 г=7,5 г
Ответ: m(соли)=7,5 г