Другие задания смотри здесь...
![]()
Контрольные вопросы
Вопрос 1 Сколько электронов может максимально находиться на одной электронной орбитали? На одной орбитали могут находиться не более двух электронов, причем их спины должны быть антипараллельными.
Вопрос 2 Сколько электронов максимально может находиться на
s-подуровне?
Два электрона, поскольку имеет 1 орбиталь, на каждой максимально может быть 2 электрона
p-подуровне?
Шесть электронов, поскольку имеет 3 орбитали, на каждой максимально может быть 2 электрона
d-подуровне?
Десять электронов, поскольку имеет 5 орбиталей, на каждой максимально может быть 2 электрона
Вопрос 3 Какой энергетический уровень заполняется раньше: первый или второй? Первый
Ответ поясните. Энергетические уровни заполняются по принципу наименьшей энергии: электроны занимают орбитали последовательно, начиная с первого энергетического уровня, в порядке увеличения энергии уровня.
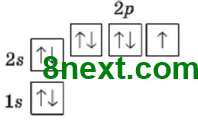
Вопрос 4 Почему в атоме Лития электрон, расположенный на втором электронном уровне, находится на s-орбитали, а не на р-орбитали? Согласно принципу наименьшей энергии каждый электрон располагается таким образом, чтобы его энергия была наименьшей. Среди названных орбиталей s-орбиталь имеет меньшую энергию.
Вопрос 5 Как распределяются электроны по орбиталям на р-подуровне?
Электрон занимает свободную орбиталь, а при отсутствии свободной — образует пару с другим электроном в полузаполненной орбитали. Другими словами по правилу Хунда: в пределах одного энергетического подуровня электроны распределяются по орбиталям таким образом, чтобы число неспаренных электронов было максимальным.
Вопрос 6 Сколько электронов находится на внешнем энергетическом уровне атомов:
а) Гелия
Два электрона
б) Лития
Один электрон
в) Бериллия
Два электрона
г) Бора
Три электрона
д) Карбона
Четыре электрона
е) Оксигена?
Шесть электронов
Для элементов главных подгрупп на количество электронов на внешнем энергетическом уровне указывает номер группы, в которой размещен элемент. Исключением является Гелий, атом имеет два электрона, но является элементом VIII группы Периодической системы.
Вопрос 7 Сколько энергетических уровней заняты электронами в атомах:
а) Лития, Натрия, Калия
Два, три, четыре энергетических уровня
б) Бериллия, Магния, Кальция
Два, три, четыре энергетических уровня
в) Флуора, Хлора, Брома
Два, три, четыре энергетических уровня
Количество энергетических уровней совпадает с номером периода, в котором размещен химический элемент.
Задания для усвоения материала
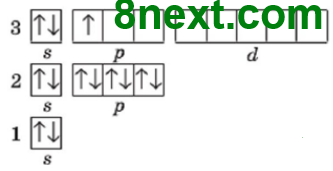
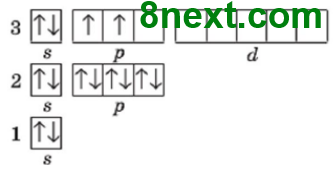
Упражнение 1 Составьте графическую электронную формулу Нитрогена, Флуора, Магния, Алюминия и Силиция. Определите число электронных пар и неспаренных электронов на внешнем энергетическом уровне.
|
Нитроген
электронных пар: 1 неспаренных электронов: 3 |
|
Флуор
электронных пар: 3 неспаренных электронов: 1 |
|
Магній
электронных пар: 1 неспаренных электронов: 0 |
|
Алюміній
электронных пар: 1 неспаренных электронов: 1 |
|
Силіцій
электронных пар: 1 неспаренных электронов: 2 |
Упражнение 2 По числу орбиталей, составляющих энергетические уровни, определите, какое максимальное число электронов может находиться на втором и третьем энергетических уровнях.
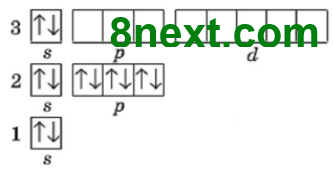
Каждый уровень с номером n содержит n2 орбиталей и 2n2 максимальное количество электронов, поэтому
2-й энергетический уровень содержит 22=4 орбитали и 2•22=2•4=8 электронов
3-й энергетический уровень содержит 32= 9 орбиталей и 2•32= 2•9=18 электронов
Обратите внимание, что третий энергетический уровень заполняется в элементов побочных подгрупп, начиная с 4 периода.
Упражнение 3 Назовите два химических элемента, в атомах которых полностью заполнены внешние энергетические уровни.
Полностью заполнены внешние энергетические уровни в атомах инертных элементов: Гелий He, Неон Ne, Аргон Ar, Криптон Kr, Ксенон Xe.
Упражнение 4 Сколько неспаренных электронов в электронной оболочке атома Оксигена? Два

Атомы какого еще химического элемента второго периода содержат такое же число неспаренных электронов? Карбона
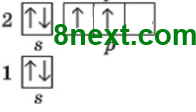
Упражнение 5 Изобразите строение электронных оболочек атомов Нитрогена и Фосфора.
Нитроген 1s22s22p3 или [He]2s22p3

Фосфор 1s22s22p63s23p3 или [Ne]3s23p3
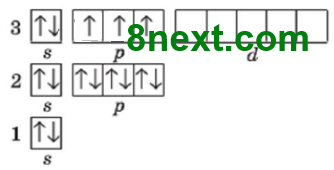
Что общего в строении электронных оболочек этих атомов?
Число электронов на внешнем энергетическом уровне (пять, из них, одна электронная пара и три неспаренных электрона).
Чем они отличаются? Числом энергетических уровней (два в атома Нитрогена, три ― Фосфора).
Упражнение 6 Атомы каких элементов имеют следующую электронную формулу внешнего электронного уровня:
а) 1s2
Гелий Не (1 ― номер периода, s-элемент ― главная подгруппа, 2 группа)
б) 2s2
Бериллий Ве (2 ― номер периода, s-элемент ― главная подгруппа, 2 группа)
в) 2s22p4
Оксиген О (2 ― номер периода, р-элемент ― главная подгруппа, 2+4=6 группа)
г) 3s23p2
Силиций Si (3 ― номер периода, р-элемент ― главная подгруппа, 2+2=4 группа)
д) 4s2?
Кальций Са (4 ― номер периода, s-элемент ― главная подгруппа, 2 группа)
Объяснение. Первая цифра в записи электронной конфигурации указывает на номер периода, в котором находится элемент, s- i p-элементы являются элементами главных подгрупп, а сумма s- и р-электронов равна номеру группы.
Упражнение 7 Атом какого элемента второго периода содержит наибольшее число:
а) электронов;
Неон Ne (10 электронов)
б) неспаренных электронов;
Нитроген N (3 неспареных электрона)
в) электронных пар?
Неон Ne (5 электронных пар)