Другие задания смотри здесь...
![]()
Контрольные вопросы
Вопрос 1 Почему первый период содержит только два химических элемента, а второй — восемь? Структура Периодической системы полностью определяется принципами строения электронной оболочки атомов.
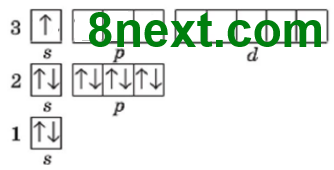
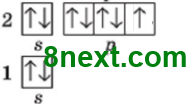
Первый энергетический уровень содержит один s-подуровень, то есть 1 орбиталь, на которой максимально содержится два электрона, поэтому первый период содержит только два химических элемента:1 Н — 2 Не
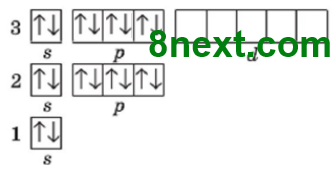
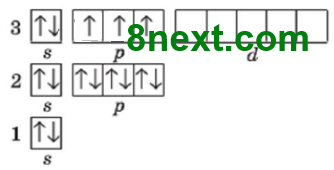
Второй энергетический уровень содержит s- и р-подуровень, из них, s-подуровень содержит 1 орбиталь и р-подуровень — 3 орбитали, вместе 4 орбитали. Каждая орбиталь содержит максимально два электрона, общее число электронов 4•2=8, поэтому второй период содержит восемь химических элемента: 3 Li — 10 N
Чем обусловлена «вместимость» периодов? Вместимостью соответствующих энергетических уровней и подуровней электронной оболочки атомов, ведь число энергетических уровней, которые заполняются в атоме определенного элемента, равен номеру периода Периодической системы, в котором расположен этот химический элемент.
Вопрос 2 Число энергетических уровней, которые заполняются электронами, определяют:
а) по номеру периода
б) номеру группы
в) порядковому номеру элемента
Ответ: а)
Вопрос 3 Число электронов на внешнем энергетическом уровне определяют по:
а) номеру периода
б) номеру группы
в) порядковому номеру
Ответ: б)
Вопрос 4 Как определить максимальное число электронов, которое может находиться на энергетическом уровне? По формуле 2n2, где n ― номер энергетического уровня.
Вопрос 5 Сколько элементов относится к четвертому и шестому периодам?
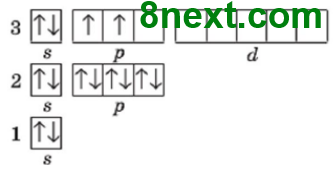
Четвертый энергетический уровень содержит s-, р- и d-подуровень, из них, s-подуровень содержит 1 орбиталь, р-подуровень ― 3, d-подуровень ― 5, вместе 9 орбиталей. Каждая орбиталь содержит максимально два электрона, общее число электронов будет 2•9=18, поэтому четвертый период содержит восемнадцать химических элемента: 19 К — 36 Kr.
Шестой энергетический уровень содержит s-, р-, d- и f-подуровень, из них s-подуровень содержит 1 орбиталь, р-подуровень ― 3,d-подуровень ― 5, f-подуровень ― 7, вместе 16 орбиталей. Каждая орбиталь содержит максимально два электрона, общее число электронов будет 2•16=32, поэтому шестой период содержит тридцать два химических элемента: 55 Sc — 86 Rn.
Сколько электронов может находиться на четвертом энергетическом уровне?
Вычисляем по формуле 2n2, где n ― номер энергетического уровня, поэтому 2•42=32 электрона
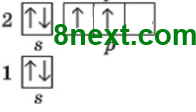
Вопрос 6 Объясните, почему Натрий и Калий являются электронными аналогами. Натрий и Калий имеют одинаковое количество электронов на внешнем энергетическом уровне и отличаются только количеством энергетических уровней, то есть, похожим является строение внешнего электронного уровня этих элементов.
Вопрос 7 По какому принципу элементы делят на s-, р-, d- и f-элементы?
Какой из подуровней: s-, р-, d- или f- заполняется последним, соответственно химический элемент будет относиться к s-, р-, d- и f-элементу.
Приведите примеры d-элементов пятого периода и f-элементов седьмого периода. d-элементами являются все элементы побочных групп этого периода, а f-элементами ― элементы семьи лантаноиды и актиноиды. Пример d-элементов: Актиний Ас, Розерфорд Rf.
Пример f-элементов: Нептун Np, Уран U.
Вопрос 8 Сколько s- и р-элементов может находиться в одном периоде? Два s-элементы и шесть р-элементов.
Почему? То, что речь идет о s- и р-элементах, означает, что последними заполняются s- или р-подуровни, из них s-подуровень содержит одну орбиталь, а р-подуровень содержит три орбитали. Каждая орбиталь содержит максимально два электрона, поэтому s-подуровень содержит два электрона, то есть, два s-элементы, а р-подуровень ― шесть электронов, то есть шесть p-элементов.
Вопрос 9 Как называют семейства химических элементов, в атомах которых последним заполняется f-подуровень? Образуют два семейства элементов — лантаноиды и актиноиды.
Задания для усвоения материала
Упражнение 1 Какой уровень состоит только:
а) из s-подуровня
Первый уровень
б) s- и р-подуровней
Второй уровень
в) s-, р- и d-подуровней
Третий уровень
Как вы это определили? По правилу: число энергетических подуровней на энергетическом уровне равно номеру этого уровня.
Упражнение 2 Какие химические элементы являются электронными аналогами Нитрогена? Все элементы V группы главной подгруппы, то есть Фосфор Р, Арсен As, Стибий Sb, Бисмут Bi, ведь они имеют одинаковое количество электронов на внешнем энергетическом уровне и отличаются только количеством энергетических уровней, то есть похожим является строение внешнего электронного уровня этих элементов.
Изобразите электронную формулу атома одного из них.
Фосфор 1s22s22p63s23p3 або [Ne]3s23p3
Упражнение 3 В чем заключается принципиальное отличие в строении электронной оболочки атомов главных и побочных подгрупп? В атомов элементов побочных подгрупп заполняются электронами d-, f-орбитали.
Упражнение 4 Какой энергетический подуровень заполняется последним в:
а) s-элементов четвертого периода
4s-подуровень
б) р-элементов пятого периода
5р-подуровень
в) s-элементов третьего периода
3s-подуровень
г) p-элементов второго периода
2р-подуровень
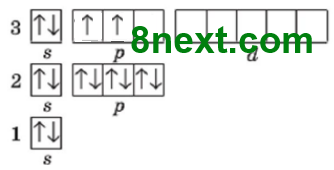
Упражнение 5 Назовите два элемента, в атомах которых число пар электронов равно числу неспаренных электронов.
В атомах Карбона и Лития число пар электронов равно числу неспаренных электронов.
| Карбон | Литий |
|
1s22s22p2
2 пары электронов 2 неспаренных электрона |
1s22s1
1 пара электронов |
Упражнение 6 Запишите электронные формулы атомов элементов с порядковыми номерами 11 и 14.
|
11Na [Ne]3s1, или 1s22s22p63s1
|
|
14Si [Ne]3s23p2, или 1s22s22p63s23p2
|
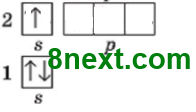
Упражнение 7 Назовите металлический и неметаллический элементы второго периода, которые на внешнем уровне имеют один неспаренный электрон.
|
металлический Литий 1s22s1
|
неметаллический Флуор 1s22s22р5
|
Упражнение 8 Какой энергетический уровень заполняется электронами в атомах элементов № 3, 9, 16?
№3 ― второй энергетический уровень, поскольку элемент 2 периода
№9 ― второй энергетический уровень, поскольку элемент 2 периода
№16 ― третий энергетический уровень, поскольку элемент 3 периода
Номер периода, в котором размещен элемент, соответствующий номеру энергетического уровня.
Упражнение 9 Составьте графическую электронную формулу атома элемента с порядковым номером 15. Составьте формулы его высшего оксида и гидратов этого оксида. Укажите химический характер оксида и гидратов.
Электронное строение Фосфора: 1s22s22р33s23p3, или [Ne]3s23p3

Неметаллический элемент, поскольку является р-элементом.
Формула высшего оксида Р2О5, гидрата оксида Н3РО4
Упражнение 10 Какой элемент второго периода является электронным аналогом элемента с порядковым номером 12? Электронными аналогами являются элементы, размещенные в одной группе и одной подгруппе. Элемент №12 — это Магний, размещен в главной подгруппе II группы, поэтому его электронным аналогом является элемент II группы главной подгруппы, например, №20 Кальций или №4 Бериллий.
Упражнение 11 Составьте графическую электронную формулу атомов:
|
Силиция Si
|
|
Бора B
|
|
Аргона Ar
|
Упражнение 12 Атомы каких элементов имеют следующее строение внешнего электронного слоя:
a) 1s22s22p3
Нитроген N
6) 1s22s22p63s23p6
Аргон Ar
в) 1s22s22p63s23p64s2
Кальций Ca
Объяснение.
Сумма электронов в записи электронной формулы атома элемента численно равна его порядковому номеру, поэтому находим сумму электронов и определяем соответствующий элемент.
а) всего 7 электронов, поскольку 1s22s22p3: 2+2+3=7, №7 — это Нитроген.
б) всего 18 электронов, поскольку 1s22s22p63s23p6: 2+2+6+2+6=18, №18 — это Аргон.
в) всего 20 электронов, поскольку 1s22s22p63s23p64s2: 2+2+6+2+6+2=20, №20 — это Кальций.
Упражнение 13 Сколько электронов находится на внешнем электронном уровне в атомах:
a) Арсена
Пять электронов, поскольку является элементом V группы
б) Cтанума
Четыре электрона, поскольку является элементом IV группы
в) Бария
Два электрона, поскольку является элементом ІІ группы
На количество электронов на внешнем уровне атома для элементов главных подгрупп указывает номер группы, в которой он размещен.