Другие задания смотри здесь...
![]()
План характеристики химического элемента.
1. Расположение в Периодической системе.
Порядковый номер, период, группа.
2. Строение атома.
Заряд ядра и его состав (количество протонов, нейтронов). Количество электронов, количество энергетических уровней и распределение в них электронов. Графическое изображение строения внешнего енергетичнго уровня, формула электронной конфигурации.
3. Характеристика химического элемента.
s-, р-, d-, f-элемент, металлический и неметаллический элемент
4. Относительная атомная масса.
5. Высшая валентность и формула высшего оксида.
6. Гидрат высшего оксида и его характер.
7. Формула летучего соединения с Гидрогеном.
8. Сравнение металлических или неметаллических свойств.
Контрольные вопросы
Вопрос 1 От чего зависит радиус атома:
а) от числа энергетических уровней
б) числа протонов
в) числа орбиталей
Ответ: а)
Вопрос 2 Что общего в строении внешней электронной оболочки металлических элементов? На внешней электронной оболочке атома содержится меньше 4 электронов.
Что общего в строении внешней электронной оболочки неметаллических элементов? На внешней электронной оболочке атома содержится 4 и более электронов.
Задания для усвоения материала
Упражнение 1 Какой из химических элементов четвертого периода проявляет наиболее сильные:
а) металлические свойства
Калий (порядковый номер №19)
б) неметаллические свойства
Бром (порядковый номер №35)
Объяснение: в периоде с увеличением порядкового номера элемента металлические свойства ослабляются, а неметаллические — усиливаются. Галогены химически инертные.
Упражнение 2 Назовите элемент главной подгруппы IV группы, у которого наиболее выражены неметаллические свойства. Карбон (№6)
Объяснение: в VI группе порядковый номер элемента Карбона является наименьшим, а в группе с уменьшением порядкового номера элемента неметаллические свойства усиливаются.
Упражнение 3 Расположите следующие символы в порядке усиления металлических свойств элементов:
а) Al, Na, Mg
В периоде с уменьшением порядкового номера элемента металлические свойства усиливаются, поэтому элементы надо расположить в такой последовательности: Al (№13), Mg (№12), Na (№11).
б) Ca, Ba, Sr
В группе с увеличением порядкового номера элемента металлические свойства усиливаются, поэтому элементы надо расположить в такой последовательности: Са (№20), Sr (№38), Ва (№56).
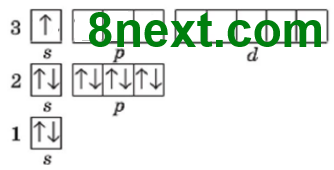
Упражнение 4 Охарактеризуйте химические элементы Бериллий, Оксиген по плану, приведенному в этом параграфе.
| Бериллий |
Оксиген |
|
Порядковый номер 4, 2-ой период, |
Порядковый номер 8, 2-ой период,VI группа, главная подгруппа |
|
Заряд ядра +4, содержит 4 протона, 5 нейтронов (9-4=5), 4 электрона. Электронная оболочка состоит с 2 энергетических уровней. На внешнем уровне содержится одна электронная пара. Строение внешнего электронного уровня:
Электронная формула: 1s22s2 |
Заряд ядра +8, содержит 8 протонов, 8 нейтронов (16-8=8), 8 электронов. Электронная оболочка состоит с 2 энергетических уровней. На внешнем уровне содержится две электронные пары и 2 неспарен- ных электрона. Строение внеш- него электронного уровня:
|
|
s-элемент, металлический, для обретения электронной конфигу- рации инертного элемента теряет 2 електрона |
р-элемент, неметаллический, до завершения электронного уровня принимает 2 електрона |
| Ar(Be)=9 | Ar(O)=16 |
|
Высшая валентность ІІ, формула высшего оксида ВеО |
Высшая валентность: ІІ ― |
|
Ве(ОН)2, основание |
― |
|
Летучего соединения с Гидрогеном не образует |
Н2О
|
|
Металлические свойства выражены сильнее, чем у Бора, но слабее, чем у Лития и Магния |
Неметаллические свойства выражены сильнее, чем у Нитрогена и Сульфура, но слабее, чем у Флуора |
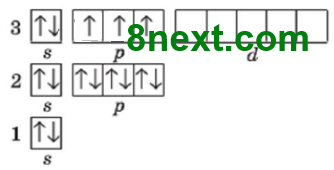
Охарактеризуйте химические элементы Натрий и Фосфор по плану, приведенному в этом параграфе.
| Натрий |
Фосфор |
|
Порядковый номер 11, 3-ий период, |
Порядковый номер 15, 3-ий период, |
|
Заряд ядра +11, содержит 11 протонов, 12 нейтронов (23-11=12), 11 электронов. Электронная оболочка состоит с трех энергетических уровней. На внешнем уровне содержится один неспаренный электрон. Строение внешнего электронного уровня: Электронная формула: 1s22s22р63s1 |
Заряд ядра +15, содержит 15 протонов, 16 нейтронов (31-15=16), 15 электронов. Электронная оболочка состоит с трех энергетических уровней. На внешнем уровне содержится одна электронная пара и три неспаренные электроны. Строение внешнего электронного уровня:
Электронная формула: 1s22s22р63s23p3 |
|
s-элемент, металлический, для обретения электронной конфи- гурации инертного элемента теряет 1 электрон |
р-элемент, неметаллический, до завершения электронного уровня принимает 3 электрона |
| Ar(Na)=23 | Ar(P)=31 |
|
Высшая валентность І, формула высшего оксида Na2О |
Высшая валентность V, формула высшего оксида P2О5 |
|
Формула гидрата высшего оксида NaОН, основание (щелочь) |
Формула гидрата высшего оксида H3PO4, кислота |
|
Летучего соединения с Гидрогеном не образует |
РН3
|
|
Металлические свойства выражены сильнее, чем у Магния и Лития, но слабее, чем у Калия |
Неметаллические свойства выражены сильнее, чем у Силиция и Арсена,но слабее, чем у Сульфура и Нитрогена |
Упражнение 5 Три элемента А, Б и В расположены в одном периоде. В атоме элемента А число энергетических уровней в два раза меньше, чем число электронов на его внешнем уровне. Элемент Б — наиболее распространенный элемент в природе, с элементом А он образует соединение состава АБ2. Элемент В образует щелочь. Эти элементы образуют вещество состава В2АБ3. Назовите все элементы и составьте формулы веществ, о которых идет речь.
Элемент А ― Карбон, Б ― Оксиген, В ― Литий (щелочь образует).
Соединение АБ2 ― СО2, В2АБ3 ― Li2СO3
Объяснение: это элементы второго периода. Атом Карбона содержит 2 энергетические уровни, а число электронов на внешнем уровне 4, поэтому число энергетических уровней в два раза меньше, чем электронов. Оксиген является наиболее распространенным элементом в природе, с Карбоном образует соединение СО2 - углекислый газ. Литий является щелочным элементом, с Карбоном и Оксигеном образует вещество состава Li2CO3
Упражнение 6* Как вы считаете, почему Гидроген иногда располагают одновременно в первой и седьмой группах Периодической системы? Простое вещество имеет похожие свойства с галогенами.