Другие задания смотри здесь...
Контрольные вопросы
Вопрос 1 Дайте определение ковалентной связи. Химическую связь, которая возникает в результате образования общих электронных пар, называют ковалентной.
Вопрос 2 Общая электронная пара — это:
а) пара электронов, принадлежащая обоим атомам, между которыми образована химическая связь;
б) пара электронов, которая не образует химической связи;
в) два электрона, которые находятся на одном энергетическом подуровне.
Ответ: а)
Вопрос 3 Какие электроны называют неспаренными? Один электрон на орбитали, называют неспаренным.
Вопрос 4 Какую электронную пару называют неподеленной? Электронную пару, которая не участвует в образовании химической связи, называют неподеленной.
Вопрос 5 Какую связь называют:
а) ординарной
Связь, возникающая благодаря образованию одной общей электронной пары, является одинарною, или ординарною.
б) двойной
Связь, возникающая благодаря образованию двух общих электронных пар, является двойной.
в) тройной
Связь, возникающая благодаря образованию трех общих электронных пар, является тройной.
Приведите примеры молекул с такими связями.
а) Н2, F2, Br2, I2
б) О2
в) N2
При взаимодействии двух атомов, каждый из которых имеет несколько неспаренных электронов, образуется сразу несколько совместных электронных пар.
Задания для усвоения материала
Упражнение 1 Сколько электронных пар и неспаренных электронов содержат на внешнем энергетическом уровне атомы:
а) Хлора
Электронных пар: 3
Неспаренных электронов: 1
б) Сульфура
Электронных пар: 2
Неспаренных электронов: 2
в) Фосфора
Электронных пар: 1
Неспаренных електронов: 3
Составьте для них формулы Льюиса:
|
.. а) :Cl. .. |
.. б) :S. . |
. а) :P. . |
Упражнение 2 Сколько неспаренных электронов содержит:
а) атом Флуора
Один неспаренный электрон (…2s22p5).
б) молекула фтора?
Не содержит неспаренных электронов, поскольку молекула образуется из двух атомов с помощью ковалентной связи.
| .. .. :F:F: .. .. |
Упражнение 3 Почему не могут существовать двухатомные молекулы инертных элементов? Во время образования химической связи атомы стремятся к тому, чтобы на их внешнем энергетическом уровне было электронов, как в атомах инертных элементов. Поскольку инертные элементы уже имеют устойчивую электронную оболочку (завершенный внешний энергетический уровень, все электроны спаренные), поэтому им не нужны "чужие" электроны, они химически инертны (химические связи не образуют).
Упражнение 4 Благодаря электронам какого уровня осуществляется связь между атомами:
а) в молекуле водорода;
Первого уровня
б) молекуле хлора?
Третьего уровня
Связь между атомами осуществляется благодаря электронам внешнего (последнего) энергетического уровня.
Упражнение 5 Составьте формулы Льюиса для молекул хлороводорода HСl, сероводорода H2S, аммиака NH3, метана CH4. Сколько общих и неподеленных электронных пар содержат атомы в каждом случае?
|
хлороводород НСl .. а) H:Cl: .. 1 общая пара, з неподеленных пар |
|
сероводорода H2S .. а) H:S:H .. 2 общие пары, 2 неподеленных пар |
|
аммиака NH3 .. а) H:N:H .. H 3 общие пары, 1 неподеленная пара |
|
метана СН4 H .. а) H:C:H .. H 4 общих пары |
Упражнение 6 Составьте формулу Льюиса для молекулы серы S2. Сколько электронных пар принимают участие в образовании ковалентной связи между атомами Сульфура? Две электронные пары участвуют в образовании ковалентной связи.
|
.. .. .. .. :S. + .S: = :S::S: . . |
Соблюдается ли правило октета? Правило октета соблюдается, каждый атом имеет восемь электронов: четыре общие для обоих атомов (две общие пары), и у каждого атома по две собственные электронные пары.
Упражнение 7 Дано три электронные формулы (смотри в учебнике). Каким из следующих веществ — NH3, HCl, О2, F2, N2, H2, HBr, Cl2 — соответствуют эти электронные формулы?
а) HCl, HBr
б) F2, Cl2
в) O2
Каким веществам не соответствует ни одна электронная формула? NH3, N2
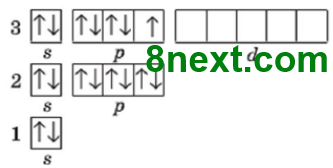
Упражнение 8* Составьте графические электронные формулы строения электронной оболочки атома Сульфура в основном и возбужденном состояниях, чтобы на внешнем электронном уровне атома было четыре и шесть неспаренных электронов.

При наличии в электронной оболочке атома свободных энергетических ячеек электроны могут из низших энергетических уровней или подуровней переместиться на более высокие, таким образом атом из основного (невозбужденного) состояния переходит в возбужденное, при этом энергия всегда поглощается и спаренные электроны становятся неспаренными.
Атом Сульфура в основном состоянии на третьем энергетическом уровне имеет 4 спаренные электроны, из них два s- и два р-электроны, и два неспаренных р-электрона, а также свободные (пустые) энергетические ячейки (d-орбитали) на d-подуровне.
Возможны возбужденные состояния:
а) получив дополнительный запас энергии, спаренный р-электрон третьего энергетического уровня переходит на d-подуровень этого же уровня и неспаренных электронов становится 4 и Сульфур проявляет валентность IV;
б) получив дополнительный запас энергии, s-электрон третьего энергетического уровня переходят на d-подуровень этого же уровня и неспаренных электронов становится 6 и Сульфур проявляет валентность VI.
Составьте формулы Льюиса для сульфур (IV) оксида и сульфур (VI) оксида.
|
O::S::O
|
O::S::O :: О |
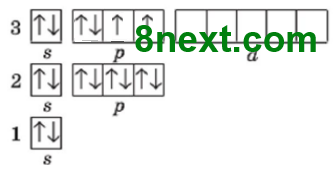
Упражнение 9* Составьте графические электронные формулы для электронных оболочек атомов Фосфора и Хлора в основном и в разных возможных возбужденных состояниях. Основываясь на них, объясните возможные валентности, которые могут проявлять атомы Фосфора и Хлора в соединениях.
Фосфор:
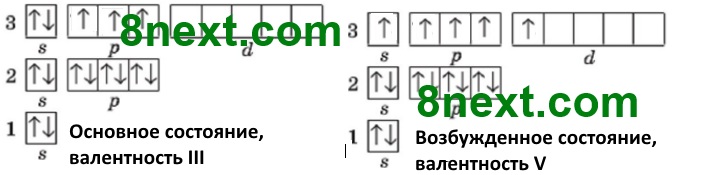
При наличии в электронной оболочке атома свободных энергетических ячеек электроны могут из низших энергетических уровней или подуровней переместиться на более высокие, таким образом атом из основного (невозбужденного) состояния переходит в возбужденное, при этом энергия всегда поглощается и спаренные электроны становятся неспаренными.
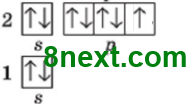
Атом Фосфора в основном состоянии на третьем энергетическом уровне имеет 2 спаренные s-электроны и 3 неспаренные р-электрона, а также свободные (пустые) энергетические ячейки (d-орбитали) на d-подуровне. Получив дополнительный запас энергии, s-электрон третьего энергетического уровня переходит на d-подуровень этого же уровня и неспаренных электронов становится 5 и Фосфор проявляет валентность V.
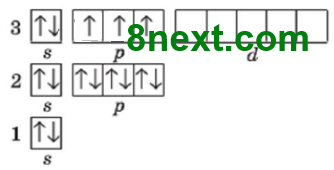
Хлор:

При наличии в электронной оболочке атома свободных энергетических ячеек электроны могут из низших энергетических уровней или подуровней переместиться на более высокие, таким образом атом из основного (невозбужденного) состояния переходит в возбужденное, при этом энергия всегда поглощается и спаренные электроны становятся неспаренными.
Атом Хлора в основном состоянии на третьем энергетическом уровне имеет 6 спаренных электронов, из них два s- и четыре р-электроны, и 1 неспаренный р-электрон, а также свободные (пустые) энергетические ячейки (d-орбитали) на d-подуровне.
Возможны возбужденные состояния:
а) получив дополнительный запас энергии, один спаренный р-электрон третьего энергетического уровня переходит на d-подуровень этого же уровня и неспаренных электронов становится 3 и Хлор проявляет валентность III;
б) получив дополнительный запас энергии, еще один спаренный р-электрон третьего энергетического уровня переходит на d-подуровень этого же уровня и неспаренных электронов становится 5 и Хлор проявляет валентность V;
в) получив дополнительный запас энергии, s-электрон третьего энергетического уровня переходят на d-подуровень этого же уровня и неспаренных электронов становится 7 и Хлор проявляет валентность VII.
Упражнение 10* Образование ковалентной связи может происходить по обменному (рекомбинационному) механизму, который описан в этом параграфе, и по донорно-акцепторному. Найдите в дополнительной литературе отличительные и общие черты этих двух механизмов. Приведите примеры частиц, образование которых происходит по донорно-акцепторному механизму образования ковалентной связи.
В обоих механизмах образование ковалентных связей происходит за счет общих электронных пар. Отличие заключается в том, что по обменному (рекомбинационному) механизму общие электронные пары появляются за счет объединения неспаренных электронов обоих атомов, а по донорно-акцепторному механизму — смещением неподеленной электронной пары одного атома в свободную орбиталь другого.
Например, в молекуле аммиака есть три простые ковалентные связи, а в ионе аммония — четыре, они одинаковые, хотя механизм их образования различен.