![]()
Сторінка 21
Вправа 1.
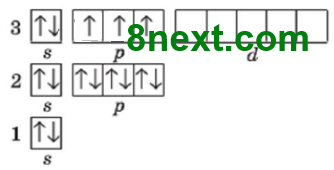
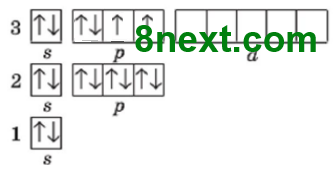
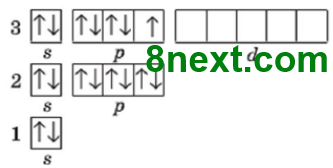
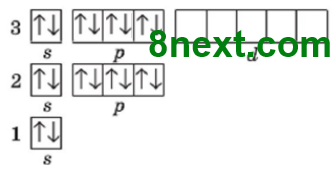
1. Використовуючи схему 1, опишіть будову електронної оболонки атомів елементів №1-20 за зразком. Пам'ятайте, що кожний електрон намагається заповнити вакантну орбіталь останнього підрівня, а в разі відсутності вакантної орбіталі «підселяється» до іншого електрона із протилежним спіном.
|
1Н +1 ) 1 1s1 Структурну формулу напишіть самостійно |
2Не +2 ) 2 1s2 Структурну формулу напишіть самостійно
|
|
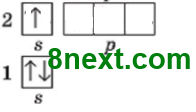
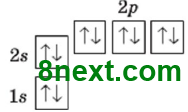
3Li +3 )) 21 1s22s1 [Не] 2s1
|
4Be +4 )) 22 1s22s2 [Не] 2s2
|
|
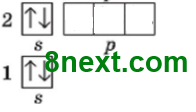
5B +5 )) 23 1s22s22p1 [Не] 2s22p1
|
6C +6 )) 24 1s22s22p2 [Не] 2s22p2
|
|
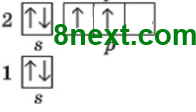
7N +7 )) 25 1s22s22p3 [Не] 2s22p3
|
8O +8 )) 26 1s22s22p4 [Не] 2s22p4
|
|
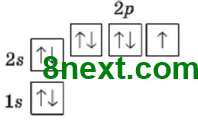
9F +9 )) 27 1s22s22p5 [Не] 2s22p5
|
10Ne +10 )) 28 1s22s22p6 [Не] 2s22p6
|
|
11Na +11 ))) 281 1s22s22p63s1 [Nе] 3s1
|
12Mg +12 ))) 282 1s22s22p63s2 [Nе] 3s2
Структурну формулу напишіть самостійно
|
|
13Al +13 ))) 283 1s22s22p63s23p1 [Nе] 2s22p1
|
14Si +14 ))) 284 1s22s22p63s23p2 [Nе] 2s22p2
|
|
15P +15 ))) 285 1s22s22p63s23p3 [Nе] 2s22p3
|
16S +16 ))) 286 1s22s22p63s23p4 [Nе] 2s22p4
|
|
17Cl +17 ))) 287 1s22s22p63s23p5 [Nе] 2s22p5
|
18Ar +18 ))) 288 1s22s22p63s23p6 [Nе] 2s22p6
|
|
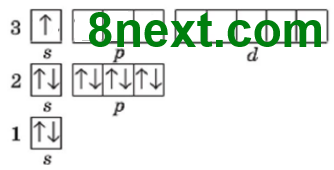
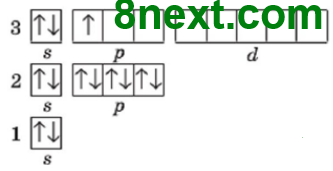
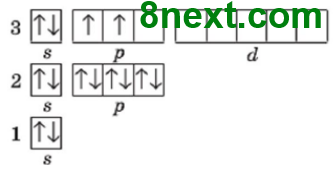
19K +19 )))) 2881 1s22s22p63s23p64s1 [Ar] 4s1 Структурну формулу напишіть самостійно
|
20Ca +20 )))) 2882 1s22s22p63s23p64s2 [Ar] 4s2
|
2. З погляду електронної будови атомів поясніть, чому 1-й період містить тільки два елементи. 1-й період має 1 енергетичний рівень, який містить 1 s-підрівень на якому максимально можуть бути 2 електрони.
Кількість підрівнів дорівнює номеру енергетичного рівня.
Висновок. В атомі Гелію перший рівень є завершеним і містить 8 електронів.
3. Як змінюється будова зовнішнього енергетичного рівня атомів елементів 2-го періоду зі зростанням заряду ядра Добавляється по одному електрону на зовнішньому енергетичному рівні атомів елементів.
4. Як змінюється будова зовнішнього рівня атомів елементів 3-го періоду? Добавляється по одному електрону на зовнішньому енергетичному рівні атомів елементів.
5. Порівняйте будову електронних оболонок атомів Літію, Натрію та Калію. Мають різну кількість електронів (3,11 і 19 відповідно), різне число енергетичних рівнів (2, 3 і 4 відповідно), але однакову кількість електронів на зовнішньому енергетичному рівні (1).
6. Порівняйте будову електронних оболонок атомів Флуору та Хлору. Мають різну кількість електронів (9 і 17) і різне число енергетичних рівнів (2 і 3), але однакову кількість електронів на зовнішньому енергетичному рівні (7).
7. Знайдіть подібні ознаки будови зовнішніх енергетичних рівнів атомів Гелію, Неону та Аргону. Останній енергетичний рівень є завершеним і містить 8 електронів.