![]()
Сторінка 22
Вправа 1. За допомогою схем будови атомів та електронних формул поясніть:
а) на яку частинку перетвориться атом Магнію, якщо він віддасть свої два зовнішніх електрони;
Mg° (+12) ))) 1s22s22p63s2 -2е Mg2+ (+12) )) 1s22s22р6 [10Ne]
атом 282 йон 28
б) на яку частинку перетвориться атом Сульфуру, якщо він приєднає два електрони;
S° (+16) ))) 1s22s22p63s23p4 +2е S2- (+16) ))) 1s22s22p63s23p4[18Ar]
атом 286 йон 288
в) на яку частинку перетвориться атом Натрію, якщо він віддасть свій зовнішній електрон.
Na° (+11) ))) 1s22s22p63s1 -1е Na+ (+11) )) 1s22s22p6[10Ne]
атом 281 йон 28
Висновок: йони — це заряджені частинки, на які перетворюються атоми внаслідок втрати або приєднання електронів.
Вправа 2. 3 погляду електронної будови атомів поясніть, чому Натрій порівняно з Алюмінієм має більш виражені металічні властивості. Атом Натрію на останньому енергетичному рівні має менше електронів, ніж Алюміній, тому легше їх віддає, щоб набути оболонку атома найближчого інертного елемента.
Вправа 3. Поясніть, чому Флуор порівняно з Оксигеном має більш виражений неметалічний характер. Атом Флуору на останньому енергетичному рівні має більше електронів , ніж атом Оксигену, тому легше приєднує електрони до завершення енергетичного рівня атома.
Вправа 4. Не складаючи електронних формул, укажіть кількість електронів на останньому енергетичному рівні в атомах Сl 7 , Pb 4 , As 5 , Кг 8 .
Кількість електронів на останньому енергетичному рівні дорівнює номеру групи Періодичної системи, в якій перебуває елемент.
Вправа 5. Атоми яких елементів мають такі електронні формули: a) 1s22s22p4; б) 1s22s22p63s23p2; в) 1s22s22p63s23p64s2? Відповідь: а) Оксиген О;б) Силіцій Si ; в) Кальцій Са.
Вправа 6. Атом елемента має на останньому енергетичному рівні 5 електронів. Скільки серед них спарених електронів, а скільки — неспарених? Спарених два s-електрони, неспарених три р-електрони.
Вправа 7. За електронною формулою (не дивлячись у Періодичну систему хімічних елементів) схарактеризуйте елемент:
|
Електронна формула |
1s22s22p63s23p5 | 1s22s22p3 | 1s22s22p63s23p64s1 | 1s22s22p6 |
|
Період, у якому розміщуєть- ся елемент |
3 | 2 | 4 | 2 |
|
Група та підгрупа |
VII головна |
V головна |
I головна |
VIIІ головна |
|
Порядковий номер елемента |
17 2+2+6+2+5=17 |
7 2+2+3=7 |
19 2+2+6+2+6+1=19 |
10 2+2+6=10 |
|
Електрони зовнішнього енергетич- ного рівня |
7 разом 7 (два s- і п'ять p- електронів) |
5 разом 5 (два s- і три p- електрони) |
1 1 s-електрон
|
8 разом 8 (два s- і шість p- електронів) |
|
Кількість неспарених електронів |
1 | 3 | 1 | 0 |
У електронній формулі на період, в якому перебуває елемент, вказує коефіцієнт біля останньої змінної.
Сторінка 29
Вправа 1.
Укажіть найактивнішій лужний елемент (І варіант);
| A Na | Б Cs | В Аl | Г Fr | Д Mg |
Укажіть найактивнішій металічний елемент 3-го періоду (II варіант):
| A Na | Б Cs | В Аl | Г Fr | Д Mg |
Вправа 2. Укажіть найактивнішій неметалічний елемент 3-го періоду (І варіант);
| А P | Б Cl | В I | Г F | Д Si |
Укажіть найактивнішій неметалічний елемент VII групи (II варіант):
| А P | Б Cl | В I | Г F | Д Si |
Вправа 3. Розташуйте хімічні елементи за посиленням:
І варіант, металічних властивостей II варіант, неметалічних властивостей
|
А Силіцій Б Магній В Натрій Г Алюміній |
А Нітроген Б Силіцій В Алюміній Г Карбон |
1-А, 2-Г, 3-Б, 4-В 1-В, 2-Б, 3-Г, 4-А
Вправа 4. У якого з елементів у кожній парі яскравіше виражено металічні або неметалічні властивості? Відповідь обґрунтуйте з погляду електронної будови атомів.
І варіант.
А Магній і Кальцій
Однакова кількість електронів на останньому енергетичному рівні, але радіус атом Кальцію більший, ніж атома Магнію.
У групах із зростанням заряду ядра атома, зростає радіус, а чим більший радіус, тим далі від ядра розміщені зовнішні електрони, тому здатність віддавати електрони зростає і металічні властивості елементів посилюються.
Б Фосфор і Хлор
Однакова кількість енергетичних рівнів, але радіус атом Хлору менший, ніж атома Фосфору.
У періодах із зростанням заряду ядра атома, зростає кількість електронів на зовншньому енергетичному рівні, а радіус зменшується, тому здатність приєднувати електрони зростає і неметалічні властивості елементів посилюються.
II варіант
А Літій і Калій
Однакова кількість електронів на останньому енергетичному рівні, але радіус атом Калію більший, ніж атома Літію.
У групах із зростанням заряду ядра атома, зростає радіус, а чим більший радіус, тим далі від ядра розміщені зовнішні електрони, тому здатність віддавати електрони зростає і металічні властивості елементів посилюються.
Б Флуор і Нітроген
Однакова кількість енергетичних рівнів, але радіус атом Флуору менший, ніж атома Нітрогену.
У періодах із зростанням заряду ядра атома, зростає кількість електронів на зовншньому енергетичному рівні, а радіус зменшується, тому здатність приєднувати електрони зростає і неметалічні властивості елементів посилюються.
Вправа 5. За будовою зовнішнього енергетичного рівня атома визначте елемент, запишіть формули його вищого оксиду та відповідного гідрату оксиду, зазначте їх хімічний характер та назви:
І варіант.
A...3s23p1;
Атом елемента має три енергетичні рівні, тому елемент розміщений у 3 періоді. На останньому енергетичному рівні атома міститься два s- і один p-електрон, разом 3 електрони, тому елемент перебуває у ІІІ групі головної підгрупи. Це Алюміній Al. Формула його вищого оксиду Al2O3 - алюміній оксид, йому відповідає гідрат оксиду Al(OH)3 - алюміній гідроксид. Амфотерний.
Б ...3s23p5.
Атом елемента має три енергетичні рівні, тому елемент розміщений у 3 періоді. На останньому енергетичному рівні атома міститься два s- і п'ять p-електронів, разом 7 електронів, тому елемент перебуває у VIІ групі головної підгрупи. Це Хлор Cl. Формула його вищого оксиду Сl2O7 - хлор (VII) оксид, йому відповідає гідрат оксиду HCl - хлоридна кислота. Кислотний.
II варіант.
A ...3s1;
Атом елемента має три енергетичні рівні, тому елемент розміщений у 3 періоді. На останньому енергетичному рівні атома міститься 1 s-електрон, тому елемент перебуває у І групі головної підгрупи. Це Натрій Na. Формула його вищого оксиду Na2O - натрій оксид, йому відповідає гідрат оксиду NaOH - натрій гідроксид. Основний.
Б ...3s23p3
Атом елемента має три енергетичні рівні, тому елемент розміщений у 3 періоді. На останньому енергетичному рівні атома міститься два s- і три p-електронів, разом 5 електронів, тому елемент перебуває у V групі головної підгрупи. Це Фосфор Р. Формула його вищого оксиду Р2O5 - фосфор (V) оксид, йому відповідає гідрат оксиду H3РО4 - ортофосфатна кислота. Кислотний.
Вправа 6. Складіть формули та назви вищих оксидів запропонованих елементів. Вкажіть їх хімічний характер. Відповідь доведіть рівняннями реакцій взаємодії оксидів з водою. Назвіть продукти реакцій.
І варіант.
А Магній;
MgO - магній оксид. Основний.
З водою взаємодіють оксиди, гідрати яких є лугами, а Mg(OH)-малорозчинна основа.
Б Сульфур.
SO3 - сульфур (VI) оксид. Кислотний.
SO3 + H2O = H2SO4 - сульфатна кислота.
II варіант.
А Літій;
Li2O - літій оксид. Основний.
Li2O + H2O = 2LiOH - літій гідроксид (луг).
Б Нітроген.
N2O5 - нітроген (V) оксид. Кислотний.
N2O5 + H2O = 2HNO3 - нітратна кислота.
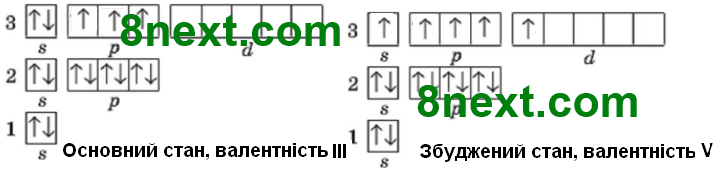
Для кмітливих
Елемент утворює летку сполуку з Гідрогеном складу ЕН3. Атом цього елемента має на один енергетичний рівень більше, ніж атом найактивнішого неметалічного елемента. Знайдіть цей елемент та складіть електронну формулу його атома в основному та збудженому станах. Які його валентні можливості? Найактивнішим неметалічним елементом є Флуор - елемент 2 періоду, атом якого має 2 енергетичні рівні. Атом шуканого елемента має 3 енергетичні рівні (2+1=3), тому елемент перебуває у 3 періоді. Валентність елемента, що утворює летку сполуку з Гідрогеном, дорівнює різниці числа 8 і номера групи (х), в якій розміщується елемент, тому 8-х=3, звідси х=5. Отже, шуканим елементом є Фосфор Р.