![]()
Сторнка 25
Вправа 1. Від яких чинників залежить радіус атома? Залежить від заряду ядра атома (кількості електронів) і кількості енергетиних рівнів електронної обололонки атома.
Вправа 2. Розмістіть елементи в порядку зростання їх атомних радіусів:
a) S, Na, Cl, Si; Si, S, Cl, Na
Елементи одного періоду і їх треба розмістити у порядку спадання зарядів ядра атома (порядкових номерів).
Чим більші заряди ядра атома, тим більші сили притягання між ними, тому меншою є відстань між зарядженими частинками, тобто між ядром атома і зовнішніми електронами, тому у періодах із зростанням заряду ядра атомів радіуси зменшуються.
б) Br, F, І, Сl. F, Cl, Br, I.
Елементи одної групи і їх треба розмістити у порядку зростання зарядів ядра атома (порядкових номерів).
Чим більші заряди ядра атома, тим більшою є кількість енергетичних рівнів атома і більшим є радіус атома, тому у групах із зростанням заряду ядра атомів радіуси збільшуються.
Вправа 3.Назвіть елемент, атом якого, на вашу думку, має:
а) найменший радіус; б) найбільший радіус. Поясніть ваш вибір.
а) Гелій Не, розміщений у верхньому правому куті Періодичної системи, бо має найменшу кількість енергетичних рівнів (=1) і більший заряд ядра (кількість електронів) серед елементів свого періоду.
б) Францій Fr, розміщений у нижньому лівому куті Періодичної системи, бо має найбільшу кількість енергетичних рівнів (=7) і найменший заряд ядра (кількість електронів) серед елементів свого періоду.
Сторінка 26.
Вправа 1.
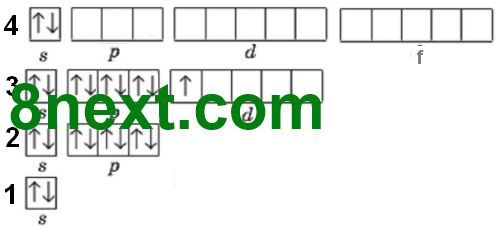
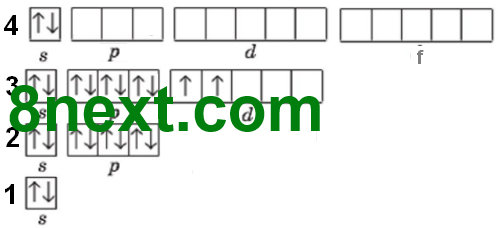
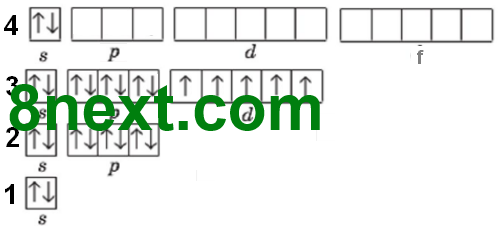
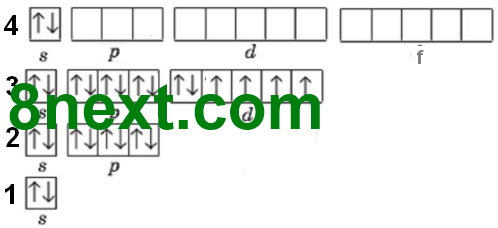
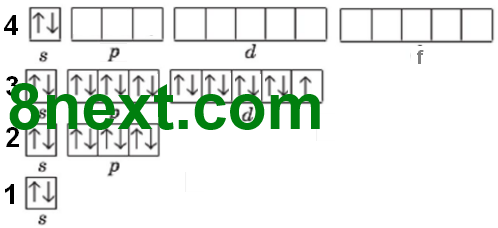
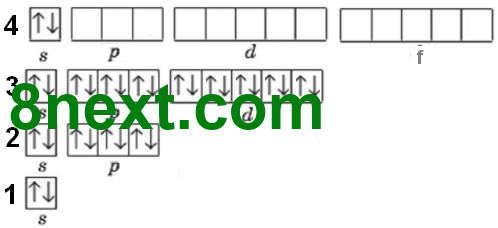
1. Після атома Кальцію в елементів 4-го періоду припиняється забудова останньо¬го енергетичного рівня і починає заповнюватися d-підрівень передостаннього рівня (елементи побічних підгруп). Опишіть будову електронної оболонки атомів елементів 4-го періоду:
|
21Sc +21 )) ) ) 28 9 2 ...3s23p63d14s2 |
22Ti +22 )) ) ) 28 10 2 ...3s23p63d24s2
|
|
23V +23 )) ) ) 28 11 2 ...3s23p63d34s2 Структурну формулу напишіть самостійно |
24Cr +24 )) ) ) 28 12 2 ...3s23p63d44s2 Структурну формулу напишіть самостійно |
|
25Mn +25 )) ) ) 28 13 2 ...3s23p63d54s2
|
26Fe +26 )) ) ) 28 14 2 ...3s23p63d64s2
|
|
27Co +27 )) ) ) 28 15 2 ...3s23p63d74s2 Структурну формулу напишіть самостійно |
28Ni +28 )) ) ) 28 16 2 ...3s23p63d84s2 Структурну формулу напишіть самостійно |
|
29Cu +29 )) ) ) 28 17 2 ...3s23p63d94s2
|
30Zn +30 )) ) ) 28 18 2 ...3s23p63d104s2
|
2. Чим відрізняються за будовою електронних оболонок атоми елементів побічних підгруп від атомів елементів головних підгруп? В атомах елементів побічних підгруп заповнюються електронами d- і f-підрівні.
3. Чому всі елементи побічних підгруп є металічними елементами? Відповідь обґрунтуйте з погляду електронної будови атомів. Бо в атомах елементів побічних підгруп починається заповнюватися електронами передостанній енергетичний рівень, а останній енергетичний рівень містить невелику кількість електронів (як правило, залишаються 2, за винятком елементів Cu i Cr - 1), тому атому легше їх віддавати, що є характерною здатністю атомів металічних елементів.
4. Елементам якої електронної родини належать такі електронні формули атомів:
a) 1s22s22p6; Родини інертних елементів.
Останній (другий) енергетичний рівень атома елемента є завершеним і містить 8 електронів (2 s- + 6 p-електрони), тому елемент перебуває у VIII групі Періодичної системи.
б) 1s22s22p63s1, Родини лужних елементів.
Останній (третій) енергетичний рівень атома елемента містить 1 s-електрон, тому елемент перебуває у І групі Періодичної системи.
в) 1s22s22p63s23p64s2? Родини лужноземельних елементів.
Останній (четвертий) енергетичний рівень атома елемента містить 2 s-електрони, тому елемент перебуває у ІІ групі Періодичної системи.