![]()
Сторінка 30
Вправа 1.
Укажіть найактивнішій лужний елемент (І варіант);
| A Na | Б Cs | В Аl | Г Fr | Д Mg |
Відповідь: Г
Укажіть найактивнішій металічний елемент 3-го періоду (II варіант):
| A Na | Б Cs | В Аl | Г Fr | Д Mg |
Відповідь: А
Вправа 2. Укажіть найактивнішій неметалічний елемент 3-го періоду (І варіант);
| А P | Б Cl | В I | Г F | Д Si |
Відповідь: Б
Укажіть найактивнішій неметалічний елемент VII групи (II варіант):
| А P | Б Cl | В I | Г F | Д Si |
Відповідь: Г
Вправа 3. Розташуйте хімічні елементи за посиленням:
І варіант, металічних властивостей
|
А Силіцій Б Магній В Натрій Г Алюміній |
Відповідь: 1-А, 2-Г, 3-Б, 4-В
II варіант, неметалічних властивостей
|
А Нітроген Б Силіцій В Алюміній Г Карбон |
Відповідь: 1-В, 2-Б, 3-Г, 4-А
Вправа 4. У якого з елементів у кожній парі яскравіше виражено металічні або неметалічні властивості? Відповідь обґрунтуйте з погляду електронної будови атомів.
І варіант.
А Магній і Кальцій
Однакова кількість електронів на останньому енергетичному рівні, але радіус атом Кальцію більший, ніж атома Магнію.
У групах із зростанням заряду ядра атома, зростає радіус, а чим більший радіус, тим далі від ядра розміщені зовнішні електрони, тому здатність віддавати електрони зростає і металічні властивості елементів посилюються.
Б Фосфор і Хлор
Однакова кількість енергетичних рівнів, але радіус атом Хлору менший, ніж атома Фосфору.
У періодах із зростанням заряду ядра атома, зростає кількість електронів на зовншньому енергетичному рівні, а радіус зменшується, тому здатність приєднувати електрони зростає і неметалічні властивості елементів посилюються.
II варіант
А Літій і Калій
Однакова кількість електронів на останньому енергетичному рівні, але радіус атом Калію більший, ніж атома Літію.
У групах із зростанням заряду ядра атома, зростає радіус, а чим більший радіус, тим далі від ядра розміщені зовнішні електрони, тому здатність віддавати електрони зростає і металічні властивості елементів посилюються.
Б Флуор і Нітроген
Однакова кількість енергетичних рівнів, але радіус атом Флуору менший, ніж атома Нітрогену.
У періодах із зростанням заряду ядра атома, зростає кількість електронів на зовншньому енергетичному рівні, а радіус зменшується, тому здатність приєднувати електрони зростає і неметалічні властивості елементів посилюються.
Вправа 5. За будовою зовнішнього енергетичного рівня атома визначте елемент, запишіть формули його вищого оксиду та відповідного гідрату оксиду, зазначте їх хімічний характер та назви:
І варіант.
A...3s23p1;
Атом елемента має три енергетичні рівні, тому елемент розміщений у 3 періоді. На останньому енергетичному рівні атома міститься два s- і один p-електрон, разом 3 електрони, тому елемент перебуває у ІІІ групі головної підгрупи.
Це Алюміній Al. Вищий оксид Al2O3 ― алюміній оксид, гідрат оксиду Al(OH)3 ― алюміній гідроксид. Амфотерний.
Б ...3s23p5.
Атом елемента має три енергетичні рівні, тому елемент розміщений у 3 періоді. На останньому енергетичному рівні атома міститься два s- і п'ять p-електронів, разом 7 електронів, тому елемент перебуває у VIІ групі головної підгрупи.
Це Хлор Cl. Вищий оксид Сl2O7 ― хлор (VII) оксид, гідрат оксиду HCl ― хлоридна кислота. Кислотний.
II варіант.
A ...3s1;
Атом елемента має три енергетичні рівні, тому елемент розміщений у 3 періоді. На останньому енергетичному рівні атома міститься 1 s-електрон, тому елемент перебуває у І групі головної підгрупи.
Це Натрій Na. Вищий оксид Na2O ― натрій оксид, гідрат оксиду NaOH ― натрій гідроксид. Основний.
Б ...3s23p3
Атом елемента має три енергетичні рівні, тому елемент розміщений у 3 періоді. На останньому енергетичному рівні атома міститься два s- і три p-електронів, разом 5 електронів, тому елемент перебуває у V групі головної підгрупи.
Це Фосфор Р. Вищий оксид Р2O5 ― фосфор (V) оксид, гідрат оксиду H3РО4 ― ортофосфатна кислота. Кислотний.
Вправа 6. Складіть формули та назви вищих оксидів запропонованих елементів. Вкажіть їх хімічний характер. Відповідь доведіть рівняннями реакцій взаємодії оксидів з водою. Назвіть продукти реакцій.
І варіант.
А Магній;
MgO ― магній оксид. Основний.
З водою взаємодіють оксиди, гідрати яких є лугами, а Mg(OH) ― малорозчинна основа.
Б Сульфур.
SO3 ― сульфур (VI) оксид. Кислотний.
SO3 + H2O = H2SO4 ― сульфатна кислота.
II варіант.
А Літій;
Li2O ― літій оксид. Основний.
Li2O + H2O = 2LiOH ― літій гідроксид (луг).
Б Нітроген.
N2O5 ― нітроген (V) оксид. Кислотний.
N2O5 + H2O = 2HNO3 ― нітратна кислота.
Для кмітливих
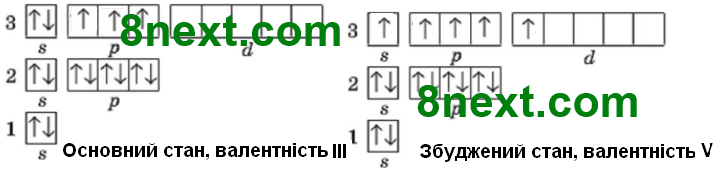
Елемент утворює летку сполуку з Гідрогеном складу ЕН3. Атом цього елемента має на один енергетичний рівень більше, ніж атом найактивнішого неметалічного елемента. Знайдіть цей елемент та складіть електронну формулу його атома в основному та збудженому станах. Які його валентні можливості? Найактивнішим неметалічним елементом є Флуор ― елемент 2 періоду, атом якого має 2 енергетичні рівні. Атом шуканого елемента має 3 енергетичні рівні (2+1=3), тому елемент перебуває у 3 періоді. Валентність елемента, що утворює летку сполуку з Гідрогеном, дорівнює різниці числа 8 і номера групи (х), в якій розміщується елемент, тому 8-х=3, звідси х=5.
Отже, шуканим елементом є Фосфор Р. У основному стані в електронній оболонці атома Фосфору є три неспарених електрони, тому валентність ІІІ, а в збудженому стані ― п'ять, тому валентність V.