![]()
Упражнение 60 По плану, приведенному в параграфе, охарактеризуйте:
План характеристики химического элемента:
1. Название и символ химического элемента, его место в периодической системе (номер периода, номер группы, главная или побочная подгруппа). Название простого вещества.
2. Относительная атомная масса.
3. Состав атома, то есть количество в нем протонов, электронов и нейтронов (если элемент принадлежит к двадцати элементам, которые имеют только один естественный нуклид: Be, F, Na, Al, P, Sc, Mn, Co, As, Y, Nb, Rb, I, Cs, Pr, Tb, Ho, Tm, Au, Bi).
4. Электронное строение атома, то есть размещение электронов на энергетических уровнях и подуровнях.
5. Тип элемента (s-,p-,d-,f-), его химический характер (металлический или неметаллический элемент).
6. Максимальное и минимальное значения валентности (за номером группы периодической системы).
7. Тип простого вещества (металл или неметалл).
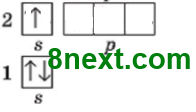
| а) Литий 1) Литий, Li, 2 период, І группа, главная подгруппа. Название простого вещества — литий. 2) Ar(Li)=7 3) №3, нуклид 7Li, N(p+)=3, N(e-)=3, N(n0)=7-3=4 4) Электронная формула: 1s22s1, или [Ne]2s1 Графическая формула:
5) s-элемент, металлический элемент 6) постоянная валентность І 7) металл |
| б) Флуор
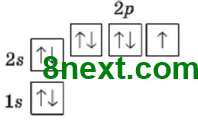
1) Флуор, F, 2 период, VII група, главная подгруппа. Название простого вещества — фтор. 2) Ar(F)=19 3) №9, нуклид 19F, N(p+)=9, N(e-)=9, N(n0)=19-9=10 4) Электронная формула: 1s22s22p5, или [He]2s22p5 Графическая формула:
5) p-элемент, неметаллический элемент 6) постоянная валентность І 7) неметалл |
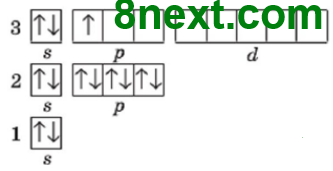
| в) Алюминий 1) Алюминий, Al, 3 период, ІІІ группа, главная подгруппа. Название простого вещества — алюминий. 2) Ar(Al)=27 3) №13, нуклид 27Al, N(p+)=13, N(e-)=13, N(n0)=27-13=14 4) Электронная формула: 1s22s22p63s23p1, или [Ne]3s23p1 Графическая формула:
5) р-элемент, металллический элемент 6) постоянная валентность ІІІ 7) металл |
| г) Сульфур
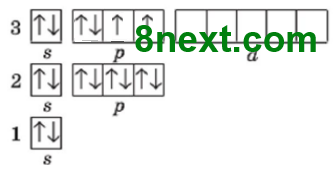
1) Сульфур, S, 3 период, VІ группа, главная подгруппа. Название простого вещества — сера. Элемент образует несколько простых веществ. 2) Ar(S)=32 3) №16, N(p+)=16 N(e-)=16 4) Электронная формула: 1s22s22p63s23p4, или [Ne]3s23p4 Графическая формула:
5) р-элемент, неметаллический элемент 6) переменная валентность: минимальная ІІ, максимальная VI 7) неметалл |
Упражнение 61 В представленном перечне укажите элементы, для которых нельзя определить количество нейтронов в ядре атома, исходя из относительной атомной массы: Na, Cl, H, Al, Fe.
Ответ: нельзя определить для тех, что представлены изотопами, то есть для Cl, H, Fe.
Перечень элементов, не имеющих изотопов, смотри в п.3. плана упражнения 60.
Упражнение 62 Назовите несколько элементов, максимальное значение валентности которых равно 7.
Ответ: Хлор Сl, Манган Mn, Бром Br, Иод І
Максимальное значение валентности элемента совпадает с номером группы, в которой он находится. Итак, это элементы VII группы (исключение Флуор F, имеет постоянную валентность I).
Упражнение 63 Для каких элементов максимальные значения валентности не совпадают с номерами групп, в которых они находятся?
|
Элемент
|
Группа
|
Максимальное значение валентности |
|
Оксиген Флуор |
VI VII |
II I |
Упражнение 64 Неметаллические элементы какой группы периодической системы имеют минимальное значение валентности, равное 2?
Ответ: VI группы
Минимальное значение валентности неметаллических элементов исчисляется по правилу: 8 минус номер группы, в которой находится элемент. Обозначим номер группы через х, тогда 8-х=2, отсюда х=6, следовательно, это элементы VI группы.
Упражнение 65 В чем сходство между водородом и хлором — простым веществом элемента VII группы? Простые вещества (газы) — состоят из двухатомных молекул: Н2 и Сl2
Чем отличается водород от натрия — простого вещества элемента І группы? Молекула водорода двухатомная, а натрия — нет. Водород — неметалл, газообразное вещество, а натрий — металл, твердое вещество.