© 8next.com (відповіді, перероблене і доповнене)
| АТОМ | ||
|
↓ ЯДРО |
↓ ЕЛЕКТРОННА ОБОЛОНКА |
|
|
↓ протони |
↓ нейтрони |
↓ електрони |
ПЛІЧ–О–ПЛІЧ
|
Дата або період часу |
Ім'я дослідника
|
Короткий опис події
|
Внесок
|
Схеми моделей чи цікаві факти
|
|
1897
|
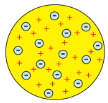
Джозеф Джон Томсон (1856–1940) |
Запропонував "пудингову" модель атома.
|
Відкрив у складі атома електрон. |
 |
|
1911– 1919
|
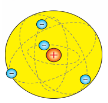
Ернест Резерфорд (1871–1937)
|
Запропонував планетарну модель атома, здійснив розщеплення ядра.
|
Відкрив у складі атома протон.
|
Удостоєний Нобелівської премії у 1908 році |
|
1935
|
Джеймс Чедвік (1891–1974)
|
Експериментально (дослідами) підтвердив наявність частинок без заряду, які назвав нейтронами. |
Підтвердив наявність нейтронів у складі атома. |
Удостоєний Нобелівської премії у 1935 році
|
|
Атом |
Протонне число, Z
|
Нейтронне число, N (N=A–Z) |
Нуклонне/масове число, A |
| Алюмінію | Z = 13 | N = 14 | A = 27 |
| Аргону | Z = 18 | N = 22 | A = 40 |
Вправа 1
––––––––––––– ПРОГРАМА 2016 року –––––––
§10 Нуклід. Ізотопи. Сучасне формулювання періодичного закону
Знаємо, розуміємо
1. За рахунок чого ізотопи одного хімічного елемента мають різні нуклонні числа? За рахунок різного числа нейтронів у ядрах атомів.
2. Зазначте, скільки протонів, нейтронів та електронів мають нукліди Калію: 39К, 40К, 41К.
Усі запропоновані нукліди мають 19 протонів, бо на число протонів вказує порядковий номер Калію (№19).
Кількість нейтронів (N) обчислюємо за формулою: N = А – Z, де А–нуклонне число, а Z–протонне число.
N(39К) =39 – 19=20
N(40К) =40 – 19=21
N(41К) =41 – 19=22
Усі запропоновані нукліди мають 19 електронів, бо атом – нейтральна частинка, тому кількість електронів і протонів однакова.
3. Поясніть, чому в окремих клітинках періодичної системи хімічні елементи розташовано не за зростанням відносної атомної маси. Бо всі хімічні елементи (без винятку!) розміщено в періодичній системі за зростанням заряду ядер їхніх атомів (порядковий номер = протонне число).
Перестановки елементів у деяких місцях періодичної системи зумовлені тим, що серед поширених у природі їхніх ізотопів переважають нукліди з більшою атомною масою, хоча заряд ядра в них менший, ніж в елемента, з яким його поміняли місцями.
Наприклад, Аргон має менший заряд ядра атома, ніж Калій. За цією ознакою його розміщено перед Калієм. Водночас в Аргону більший відсоток важких нуклідів, унаслідок чого середнє значення його відносної атомної маси більше, ніж у Калію.
4. У «Хімічній енциклопедії» подано такі відомості про Магній: «складається з трьох стабільних ізотопів: 24Mg (78,6 %), 25Mg (10,11 %), 26Mg (11, 29 %)». Обчисліть за цими даними середню відносну атомну масу Магнію та порівняйте її із зазначеною в періодичній системі хімічних елементів.
Відомо: ω(24Mg)=78,6% або 0,786,
ω(25Mg)=10,11% або 0,1011, ω(26Mg)=11,29% або 0,1129.
Знайти: Arср.(Mg) –?
Розв'язання
Для цього масову частку атомів кожного ізотопу помножимо на його нуклонне число та знайдемо суму трьох добутків:
Arср.(Mg) = 24 • 0,786 + 25 • 0,1011 + 26 • 0,1129=
=18,864+2,5275+2,9354=24,3269, або заокруглено 24,3.
Відносна атомна маса хімічного елемента, яку записано в періодичній системі, — це середнє значення атомної маси всіх його нуклідів.
5. Проаналізуйте твердження та оберіть правильний варіант відповіді.
Твердження 1. У рядку: а) 4018Ar, б) 4019K, в) 4020Ca ізотопи відсутні.
Твердження 2. У рядку: а) 6430Zn, б) 6630Zn, в) 6730Zn записано ізотопи.
Ізотопи – це нукліди, що належать одному хімічному елементу, мають однакове число протонів, але відрізняються за кількістю нейтронів.
У твердженні 1. рядок сформований з нуклідів різних хімічних елементів, тому про наявність чи відсутність ізотопів у такому ряді не можна нічого стверджувати.
Застосовуємо
Вправа 38
Обчисліть, скільки нейтронів має кожний з нуклідів Оксигену: 168O, 178O, 188O.
Кількість нейтронів (N) обчислюємо за формулою: N = А – Z, де А–нуклонне число, а Z–протонне число.
N(168О) =16 – 8=8
N(178О) =17 – 8=9
N(188О) =18 – 8=10
Вправа 39
Прокоментуйте запис якомога більшою кількістю наукової інформації: 130Ва, 132Ва, 134Ва, 138Ва.
Нукліди запропонованого ряду є ізотопами хімічного елемента Барію з протонним числом (порядковий номер елемента) 56 і числом електронів 56. Нуклонні числа згідно формул запропонованих ізотопів є такими: 130, 132, 134 і 138. Оскільки нейтронне число є різницею нуклонного та протонного чисел, тому у ядрах атомів запропонованих ізотопів будуть міститись відповідно 74, 76, 78, 82 нейтронів.