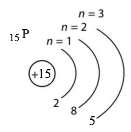Інші завдання дивись тут...
© 8next.com (відповіді, перероблене і доповнене)
• Наведи означення Сонячної системи.
Сонячна система — планетна система, що включає центральну зорю Сонце і менші об'єкти, які обертаються навколо його орбіти — планети і їх супутники тощо.
• Що в періодичній таблиці називають періодом, скільки в ній періодів?
Період — фрагмент природного ряду хімічних елементів від лужного елемента до інертного.
ОПРАЦЮЙ ЗРОЗУМІЙ ВИКОРИСТАЙ
Завдання 1
Чим відрізняються s–орбіталі від р–орбіталей?
Форма s–орбіталі — сферична. У центрі такої орбіталі розміщене ядро атома.
Форма р–орбіталі — гантелеподібна. Такі орбіталі зорієнтовані в атомі перпендикулярно одна до одної вздовж осей координат х (позначення — px–орбіталь), у (py–орбіталь) і z (pz–орбіталь), в точці перетину координат (місце звуження гантелей) розміщене ядро атома.
Завдання 2
Розташуй елементи N, Ba, He, Si, Ca в послідовності збільшення кількості енергетичних рівнів. Атом якого з наведених елементів має найбільшу кількість електронів?
На кількість енергетичних рівнів в електронній оболонці атома вказує номер періду періодичної таблиці, в якому елемент розміщений. Елемент N міститься в 2 періоді, Ba 6 періоді, He 1 періоді, Si 3 періоді, Ca 4 періоді, тому будуть розташовуватися в послідовності збільшення номеру періоду елементи так: He, N, Si, Ca, Ba.
Найбільшу кількість електронів має елемент Ва, бо міститься в 4 періоді, має найбільший порядковий номер.
Відповідь: послідовність He, N, Si, Ca, Ba; атом Ва має найбільше електронів.
Завдання 3
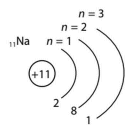
Застосуй здобуті знання для відповіді на запитання, що стосуються моделі атома Натрію, та з’ясуй:
а) кількість електронів в електронній оболонці атома Натрію.
В електронній оболонці атома Натрію 11 електронів.
Як довідатись про це, користуючись періодичною таблицею?
Кількість електронів в електронній оболонці атома Натрію дорівнює його порядковому номеру в періодичній таблиці. Елемент Натрій має порядковий номер 11, тому в електронній оболонці атома Натрію міститься 11 електронів.
б) кількість енергетичних рівнів в електронній оболонці атома Натрію. Енергетичних рівнів є 3.
Чи збігається вона з номером періоду, в якому розміщений Натрій?
Елемент Натрій розміщений в 3 періоді періодичної таблиці і в електронній оболонці атома Натрію є три енергетичних рівнів, тому збігається.
в) кількість електронів на зовнішньому і внутрішньому енергетичних рівнях атома Натрію.
На зовнішньому енергетичному рівні атома Натрію міститься 1 електрон, а на внутрішньому — 2 електрони.
НУМО ДОСЛІДЖУВАТИ
Завдання 1
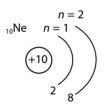
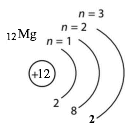
Зі скількох енергетичних рівнів складається електронна оболонка атома кожного хімічного елемента?
|
Хімічний
елемент
|
Неон
Ne
|
Магній
Mg
|
Фосфор
P
|
|
Будова
електронної
оболонки
атома
|
 |
 |
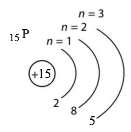 |
|
Кількість
енергетичних
рівнів
|
Два
|
Три
|
Три
|
Завдання 2
За моделями досліди кількість електронів на енергетичних рівнях і підрівнях в атомах Неону, Магнію і Фосфору та сформулюй відповіді на дослідницькі запитання, наведені в таблиці 21.
|
Дослідницьке запитання
|
Відповідь
|
|
1. З'ясуй, скільки електронів є на кожному енергетичному рівні електронної оболонки досліджуваного атома
|
Хімічний елемент
|
1
рівень
|
2
рівень
|
3
рівень
|
|
Неон
|
2
|
8
|
—
|
|
Магній
|
2
|
8
|
2
|
|
Фосфор
|
2
|
8
|
5
|
|
2. Визнач, по скільки електронів перебуває на кожному енергетичному підрівні в межах існуючих у атома рівнів
|
Хімічний елемент
|
1
рівень
|
2
рівень
|
3
рівень
|
|
Неон
|
2s
|
2s i 6p
|
—
|
|
Магній
|
2s
|
2s i 6p
|
2s
|
|
Фосфор
|
2s
|
2s i 6p
|
2s i 3p
|
|
3. З'ясуй, що спільного та чим відрізняється будова електронних оболонок атомів Неону, Магнію, Фосфору
|
Спільне: кількість електронів на 1–ому (2) і 2–ому енергетичних рівнях (8), кількість електронів на 1–ому підрівні (2s) і 2–му підрівні (2s i 6p)
|
|
Відмінне: кількість енергетичних рівнів (2, 3 і 3 відповідно), кількість електронів на зовнішньому енергетичному рівні (8, 2 і 5 відповідно), кількість електронів на 3–ому підрівні (0, 2s, 2s i 2p відповідно).
|
|
4. Запиши номери енергетичних рівнів з максимально можливою кількістю електронів
|
У Неону: 1–й (2е–), 2–й (8е–)
У Магнію: 1–й (2е–), 2–й (8е–), 3–й (18е–)
У Фосфору: 1–й (2е–), 2–й (8е–), 3–й (18е–)
|
ПЛІЧ–О–ПЛІЧ
Завдання 1
Заповніть таблицю необхідною науковою інформацією.
|
Характеристика
|
Підрівні
|
|
Позначення підрівні
|
s
|
p
|
d
|
f
|
|
Можливі підрівні на енергетичному рівні
(поставити у відповідній клітинці / клітинках знак «+»)
|
|
Енергетичний
рівень 1
|
+
|
|
|
|
|
Енергетичний
рівень 2
|
+
|
+
|
|
|
|
Енергетичний
рівень 3
|
+
|
+
|
+
|
|
Завдання 2
На підставі занесених у таблицю даних з’ясуйте й запишіть, яка максимальна кількість електронів може бути на кожному із перших трьох енергетичних рівнів.
1-й енергетичний рівень має s–підрівень, з максимально можливою кількістю 2 електрони.
2-й енергетичний рівень має s–підрівень, з максимально можливою кількістю 2 електрони, і р–підрівень — 6 електронів, разом з максимально можливою кількістю 8 електронів.
3-й енергетичний рівень має s–підрівень, з максимально можливою кількістю 2 електрони, р–підрівень — 6 електронів, і d–підрівень — 10 електронів, разом з максимально можливою кількістю 18 електронів.
ТОБІ ДО СНАГИ
Вправа 1
Яка максимальна кількість енергетичних рівнів може бути в електронній оболонці атома?
Максимальна кількість енергетичних рівнів 7.
Вправа 2
Поясни причиново–наслідкові зв'язки між будовою електронної оболонки атома і номером періоду, в якому хімічний елемент розташований у періодичній таблиці.
Перший енергетичний рівень містить s-підрівень з максимально можливою кількістю — 2 електрони. Ось чому 1-й період періодичної таблиці містить 2 хімічні елементи: Гідроген H (№1) і Гелій Не (№2).
Другий енергетичний рівень містить s-підрівень, з максимально можливою кількістю 2 електрони, і p-підрівень — 6 електронів, разом максимально можлива кількість — 8 електронів. Ось чому 2-й період періодичної таблиці містить 8 хімічних елементів, починається Літієм Li (№3) і закінчується Неоном Ne (№10).
Третій енергетичний рівень містить s-підрівень, з максимально можливою кількістю 2 електрони, p-підрівень — 6 електронів і d-підрівень — 10 електронів (порожній), разом максимально можлива кількість — 8 електронів. Ось чому 3-й період періодичної таблиці містить 8 хімічних елементів, починається Натрієм Na (№11) і закінчується Аргоном Ar (№18).
Аналогічно доводиться для решти енергетичних рівнів.
Отже, кількість енергетичних рівнів в електронній оболонці атома елемента дорівнює номеру періоду періодичної таблиці, в якому цей елемент міститься.
Вправа 3
Увідповідни енергетичний підрівень і максимальну кількість електронів на ньому.
|
Енергетичний
підрівень
|
Максимальна
кількість електронів
|
|
1 s
2 р
3 d
4 f
|
А 18
Б 14
В 10
Г 8
Д 2
|
Відповідь: 1—Д, 2—Г, 3—В, 4—Б.
Вправа 4
Скільки енергетичних рівнів в електронній оболонці атомів Сульфуру й Аргону? Звідки ти здобув / здобула цю інформацію?
В електронній оболонці атома Сульфуру й Аргону є три енергетичні рівні.
Я здобув/здобула цю інформацію з Періодичної таблиці. Знаю, що на число енергетичних рівнів вказує номер періоду, в якому хімічні елементи розміщені, а Сульфур і Аргон є елементами 3 періоду.
Однакова чи різна кількість енергетичних рівнів / електронних шарів у атомах елементів із атомними номерами 7 і 15?
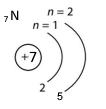
Атомний номер 7 має хімічний елемент Нітроген (N), а атомний номер 15 — Фосфор (Р). Це хімічні елементи 2–го і 3–го періодів відповідно, тому різною є кількість енергетичних рівнів в атомах цих елементів: 2 і 3 відповідно.
Запиши схеми будови енергетичних рівнів атомів цих елементів.
| Нітроген |
Фосфор |
|
|
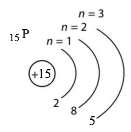
|
Розмісти елементи Гелій, Калій, Літій за збільшенням кількості енергетичних рівнів в електронній оболонці атома.
На кількість енергетичних рівнів в електронній оболонці атома вказує номер періоду, в якій розміщений хімічний елемент. Гелій (He) є елементом періоду 1, Калій (К) — періоду 4, а Літій (Li) — періоду 2, тому в порядку збільшення кількості енергетичних рівнів розміщення елементів: He, Li, K.
Відповідь: He, Li, K.
Вправа 7
Проаналізуй твердження та обери те, що вважаєш правильним.
Твердження 1. Спільним у будові електронних оболонок атомів із протонними числами 11 і 18 є наявність трьох енергетичних рівнів.
Твердження 2. Нукліди Карбону 162С і 163С мають різну кількість енергетичних рівнів.
Однакова кількість енергетичних рівнів, бо є нуклідами одного хімічного елемента Карбону.
––––––––––––– ПРОГРАМА 2016 року –––––––
§11 Стан електронів в атомі. Електронні орбіталі. Енергетичні рівні
Знаємо, розуміємо
1 У чому виявилась недосконалість планетарної моделі атома порівняно із сучасною квантово–механічною? Планетарна модель не давала чітких уявлень про розподіл електронів у атомному просторі, що дістав назву електронної оболонки атома, і їх рух.
Поясніть, якими є сучасні погляди на стан електрона в атомі. Електрон одночасно виявляє властивості і частинки, і хвилі, тобто має двоїсту природу, тому рух електрона в атомі не можна описати певною траєкторією, а лише розглядати деякий об’єм простору, в якому найчастіше перебуває електрон. Тому при визначенні положення електронів в атомі використовують поняття про орбіталь, як частину простору, де перебування електрона найімовірніше.
2 Дайте визначення:
а) атомної орбіталі;
Атомна орбітàль — це геометричний образ, який відповідає об’єму простору навколо ядра, ймовірність перебування електрона в якому є досить високою (дорівнює 90–95 %).
б) електронної хмари;
Електронна хмара — це наочне зображення атомної орбіталі.
в) енергетичного рівня.
Електрони з однаковим чи приблизно однаковим запасом енергії утворюють один енергетичний рівень, або електронний шар.
3 Яку форму електронної хмари мають s– і р–електрони?
Форму кулі (сферичну) і форму об'ємної вісімки (гантелеподібну, причому ядро атома міститься у місці звуження гантелі).
| Форма електронної хмари |
| s–електрони |
р–електрони |
 |
 |
4 Однаковим чи різним запасом енергії наділені електрони:
а) одного енергетичного рівня; Однаковим.
б) різних енергетичних рівнів? Різними.
5 Що означає збуджений стан атома? Як його досягають?
Збуджений стан атома — це стан атома у якому певні електрони, отримавши додатковий запас енергії, перейшли на вищий рівень.
Застосовуємо
Вправа 36 Розташуйте елементи за збільшенням кількості енергетичних рівнів в електронній оболонці атома.
| А Літій |
Б Калій |
В Гелій |
Г Магній |
Відповідь: В А Г Б
На кількість енергетичних рівнів в електронній оболонці атома вказує номер періоду, в якій розміщений хімічний елемент.
Вправа 37 Установіть відповідність між хімічними елементами та кількістю енергетичних рівнів в електронних оболонках їх атомів.
| Елемент |
Кількість енергетичних рівнів |
|
1 Ферум
2 Алюміній
3 Карбон
4 Гідроген
|
А 1
Б 2
В 3
Г 4
Д 5
|
Відповідь: 1—Г, 2—В, 3—Б, 4—А.
Кількість енергетичних рівнів співпадає з номером періоду, в якому розміщений хімічний елемент.
Вправа 38 Як ви розумієте вислів: «Електрон так само невичерпний, як і атом»? Електрон нікуди не зникає, він може тільки перейти з одного стану в інший (збуджений).
Інші завдання дивись тут...