|
Підрівень
|
Максимальна кількість електронів на підрівні |
Кількість енергетичних комірок і максимальне заповнення їх електронами
|
|
| s–підрівень | 2 | 1 | |
| p–підрівень | 6 | 3 | |
| d–підрівень | 10 | 5 | |
| f–підрівень | 14 | 7 | |
| Натрій | 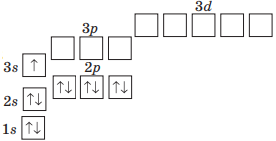 |
| Магній | 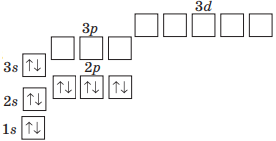 |
| Алюміній | 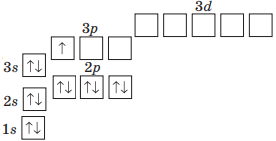 |
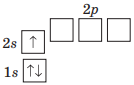
| Літій Li | Натрій Na |
 |
 |
| Спільне: на зовнішньому енергетичному рівні 1 електрон. | |
б) 7 і 15;
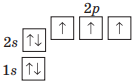
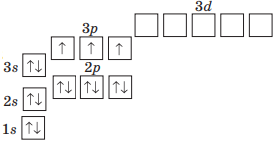
| Нітроген N | Фосфор P |
 |
 |
|
Спільне: на зовнішньому енергетичному рівні 5 електронів, з них, 2 спарених електрони і 3 неспарених електронів. |
|
в) 8 і 16.
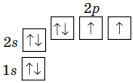
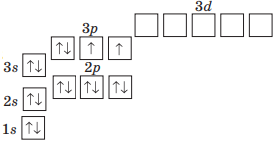
| Оксиген О | Сульфур S |
 |
 |
|
Спільне: на зовнішньому енергетичному рівні 6 електронів, з них, 4 спарених електрони і два неспарених електрони. |
|
ТОБІ ДО СНАГИ
§12 Поняття про енергетичні підрівні. Радіус атома
Знаємо, розуміємо
1. Чому дорівнює максимальна кількість енергетичних рівнів? Сім.
Як визначити, скільки енергетичних рівнів має електронна оболонка конкретного атома? Кількість енергетичних рівнів в електронній оболонці атома кожного елемента дорівнює номеру періоду, в якому розміщений хімічний елемент.
2. Назвіть енергетичні підрівні з такою максимальною кількістю електронів на них:
а) 2 e ; s – підрівень
б) 14 e ; f – підрівень
в) 6 e ; p – підрівень
г) 10 e . d – підрівень
Дивись пояснення до вправи 3.
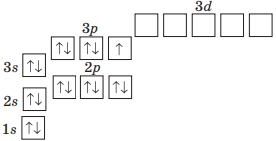
3. Яка максимальна кількість електронів може перебувати на s–, p–, d–, f–підрівнях? Два, шість, десять, чотирнадцять.
s–підрівень складається з однієї s–орбіталі, а кожна орбіталь містить максимально два електрони, тому загальне число електронів буде два.
р–підрівень складається з трьох р–орбіталей, а кожна орбіталь містить максимально два електрони, тому загальне число електронів буде шість.
d–підрівень складається з п'яти d–орбіталей, а кожна орбіталь містить максимально два електрони, тому загальне число електронів буде десять.
f–підрівень складається з семи f–орбіталей, а кожна орбіталь містить максимально два електрони, тому загальне число електронів буде чотирнадцять.
4. Чи може бути (відповідь обґрунтуйте) на s–підрівні:
а) 1 електрон; Може, бо максимальна кількість електронів на s–підрівні 2, а 1<2.
б) 2 електрони; Може. Це максимальна кількість електронів на s–підрівні.
в) 6 електронів? Ні не може, бо максимальна кількість електронів на s–підрівні 2, а 2<6.
5. Назвіть підрівні третього енергетичного рівня. s–, p–, d–підрівні.
Число енергетичних підрівнів на енергетичному рівні дорівнює номеру цього рівня.
6. Знайдіть і виправте помилки, якщо вони є, у поданих твердженнях.
Твердження 1. Кількість енергетичних рівнів визначається номером групи.
Твердження 2. Кількість електронів в атомі дорівнює його відносній атомній масі.
У першому твердженні замість слова "групи" треба написати "періоду", а у другому твердженні замість слів "відносній атомній масі" треба написати "порядковому номеру".
7. Знайдіть і виправте помилки, якщо вони є, у поданих твердженнях.
Твердження 1. Спільним у будові електронних оболонок атомів з порядковими номерами 11 і 18 є наявність трьох енергетичних рівнів.
Твердження 2. Радіус атома зі збільшенням заряду ядра атомів у періоді зменшується, а в підгрупі — зростає.
Помилок у твердженнях немає.
8. Як і чому змінюється радіус атомів хімічних елементів одного періоду? Радіус атомів зменшується із збільшенням заряду ядра (зростанням порядового номера елемента). Це пояснюється зростанням притягування зовнішніх електронів до ядра, бо їх кількість зростає від 1 до 7.
9. Як і чому змінюється радіус атомів хімічних елементів в межах головної підгрупи? Радіус атомів збільшується із збільшенням заряду ядра (зростанням порядового номера елемента). Це пояснюється збільшенням кількості енергетичних рівнів (зростає номер періоду).