Інші завдання дивись тут...
Завдання 1
Поясни, що означає термін «субатомні частинки». Наведи приклади.
Термін «субатомні частинки» характеризує всі частинки, з яких складається атом.
Наведи приклад. Протони, електрони, нейтрони.
Завдання 2
Як дізнатися про кількість субатомних частинок в атомі? Пояснення ілюструй на прикладі атома Алюмінію.
На кількість протонів вказує порядковий номер елемента. Алюміній має порядковий номер 13, тому число протонів дорівнює 13. Число електронів дорівнює числу протонів, тому електронів теж 13. Для обчислення нейтронного числа необхідно від нуклонного числа відняти протонне: N = А – Z = 27 – 13 = 14, тому в ядрі атома Алюмінію 14 нейтронів.
Завдання 3
Порівняй за масою і зарядом:
а) протон та електрон;
Маса протона більша від маси електрона. Протон — позитивно заряджена частинка атома, а електрон — негативно заряджена.
б) протон і нейтрон.
Маса протона і нейтрона однакова, дорівнює 1. Протон — позитивно заряджена частинка атома, а нейтрон заряду не має (0).
Завдання 4
Що розуміють під протонним числом, нуклонним / масовим числом?
Протонним числом (Z) називають кількість протонів у ядрі атома, воно збігається з порядковим номером хімічного елемента у періодичній таблиці.
Нуклонне, або масове число (А) — сума протонного і нейтронного чисел: А = Z + N.
Завдання 5
Чи можуть ядра атомів, які мають однакове нуклонне / масове число, належати різним елементам? Поясни свою відповідь.
Ні, не можуть належати різним елементам. Нуклонне, або масове число (А) — сума протонного і нейтронного чисел. Протонним числом (Z) називають кількість протонів у ядрі атома, воно збігається з порядковим номером хімічного елемента у періодичній таблиці, тобто мова йде про атом одного хімічного елемента.
Завдання 6
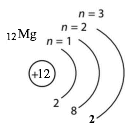
Увідповідни цифрові позначення на малюнку й підписи.
3 — неспарений електрон
4 — другий енергетичний рівень
1 — третій енергетичний рівень
5 — ядро атома
2 — перший енергетичний рівень
Завдання 7
Атом має 12 протонів і 12 нейтронів. Обчисли масове число атома. Який це хімічний елемент?
Масове число (А) — сума протонного і нейтронного чисел: А = Z + N = 12 + 12 = 24. Масове число 24 має атом хімічного елемента Магній.
Завдання 8
Порівняй кількість субатомних частинок у нуклідах 2713Al і 2913Al.
Для нукліда 2713Al: Z = 13, А = 27, N = 27 – 13 = 14
Для нукліда 2913Al: Z = 13, A = 29, N = 29 – 13 = 16
Отже, два нукліди мають однакову кількість протонів і електронів, а відрізняються кількістю нейтронів (14 і 16 відповідно).
Завдання 9
Проаналізуй дані таблиці й укажи нукліди одного хімічного елемента.
Нукліди А і В є нуклідами одного хімічного елемента.
Завдання 10
Нуклід Брому має масове число 80 і містить 35 електронів. Скільки протонів і нейтронів у нукліда Брому та який заряд його ядра?
Кількість електронів дорівнює числу протонів, тому нуклід Брому має 35 протонів
(Z = 35). Заряд ядра +35. Для обчислення нейтронного числа необхідно від
масового числа відняти протонне: N = А – Z = 27 – 13 = 14, тому в ядрі атома Брому 14 нейтронів.
Завдання 11
Поясни зміст понять «електронна орбіталь», «енергетичний рівень», «енергетичний підрівень».
Електронна орбіталь — це ділянка з найбільшою ймовірністю перебування електрона.
Електрони з однаковим чи приблизно однаковим запасом енергії об’єднують в один енергетичний рівень, або електронний шар.
Для характеристики електронів одного енергетичного рівня, що мають однакову форму атомної орбіталі, введено поняття енергетичний підрівень.
Завдання 12
Для атома елемента, який має 13 протонів, визнач кількість електронів і нейтронів, якщо масове число елемента 27. На яких енергетичних рівнях цього атома розташовані електрони?
Z = 13, A = 27, N = A – Z = 27 – 13 = 14. Отже, атом має 13 електронів і 14 протонів.
Хімічний елемент з порядковим номером 13 розміщений у 13 групі, тому електрони розташовані на 3 енергетичних рівнях.
Завдання 13
Розташуй елементи в послідовності зменшення кількості електронів в атомі: Se, I, K, Fe, Cl, Li, S. Укажи елементи з однаковою кількістю енергетичних рівнів в електронній оболонці.
Порядковий номер елемента вказує на число протонів і електронів.
Порядкові номери хімічних елементів:
Se №34, I №53, K №19, Fe №26, Cl №17, Li №3, S №16.
Розташуємо в порядку зменшення кількості електронів в атомах елементів:
I, Se, Fe, K, Cl, S, Li.
Однакову кількість енергетичних рівнів в електронній оболонці мають:
Fe i K (3 енергетичні рівні) і Cl i S (2 енергетичні рівні).
Завдання 14
Заповни в зошиті таблицю.
|
Енергетичний
рівень
|
Максимальна кількість
електронів на рівні
|
Форми атомних
орбіталей
|
| 1 |
2 |
s |
| 2 |
8 |
s і p |
| 3 |
18 |
s, p, d |
Завдання 15
За схемою електронної оболонки атома визнач хімічний елемент, напиши електронну формулу атома.
)))
288
Атом хімічного елемента Аргон Ar.
Електронна формула атома: 1s22s22p63s23p6
Укажи:
— заряд ядра; +18
— кількість енергетичних рівнів; 3
— номер періоду, в якому розміщений елемент; 3
— номер групи у довгій формі періодичної таблиці; 18
— номер групи і підгрупу в короткій формі періодичної таблиці; VIII група і головна підгрупа
— кількість електронів на зовнішньому енергетичному рівні; 8
— завершеним чи незавершеним є зовнішній енергетичний рівень. Завершеним
Завдання 16
Чому Натрій розміщений у третьому періоді, а Нітроген — у другому?
Електронна оболонка атома Натрію містить 3 енергетичні рівні, а Нітрогену — 2 енергетичні рівні, а число енергетичних рівнів в електронній оболонці атома збігається з номером періоду, в якому розміщений хімічний елемент.
Завдання 17
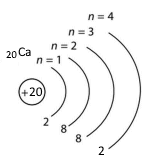
Користуючись схемою і науковою термінологією, порівняй будову атомів Магнію і Кальцію.
У ядрі атома Магнію міститься 12 протонів і 12 нейтронів. Електронна оболонка атома містить 12 електронів, які розміщені на трьох енергетичних рівнях. На зовнішньому енергетичному рівні містяться 2 електрони.
У ядрі атома Кальцію міститься 20 протонів і 20 нейтронів. Електронна оболонка атома містить 20 електронів, які розміщені на чотирьох енергетичних рівнях. На зовнішньому енергетичному рівні містяться 2 електрони.
Завдання 18
Що про будову атома можна дізнатись за його електронною оболонкою? Поясни на прикладі будь–якого елемента з 1–3 періодів.
Хімічний елемент Натрій з порядковим номером 11 розташований в 3 періоді, 1 групі.
В електронній оболонці атома міститься 11 електронів, які розташовані на 3 енергетичних рівнях. На останньому енергетичному рівні міститься 1 електрон.
Завдання 19
Увідповідни схему електронної оболонки атома і період, в якому розміщений хімічний елемент.
| Електронна структура |
Період |
|
1 ))
24
|
А 1 |
|
2 )
2
|
Б 3 |
|
3 )))
281
|
В 2 |
Відповідь: 1—В, 2—А, 3—Б
Завдання 20
Визнач хімічний елемент, зовнішня електронна оболонка якого має будову …2s22p3. Для цього елемента:
а) схарактеризуй місце в періодичній таблиці (короткій і довгій формах);
Хімічний елемент розташований в 2 періоді періодичної таблиці, в V групі короткої форми або 15 групі довгої форми.
б) сформулюй висновок щодо зв’язку будови атома й місця елемента в періодичній таблиці;
У 2 періоді в 15 групі розташований хімічний елемент Нітроген. Електронна оболонка атома складається з двох енергетичних рівнів, на останньому енергетичному рівні міститься 5 електронів.
в) назви відомі тобі речовини, до складу яких входить цей елемент, і галузі їх застосування.
Азот, азотні добрива, аміак.
Азот повітря використовують у виробництві аміаку, азотної кислоти, добрив, а також як інертний газ.
_____________________ У виданні 2016 року _____________
§14 Графічні електронні формули атомів хімічних елементів
Знаємо, розуміємо
1. Дайте визначення графічної електронної формули атома. Відображення розподілу електронів за енергетичними комірками називається графічною електронною формулою.
2. Скільки енергетичних комірок необхідно для розміщення максимально можливої кількості електронів:
а) першого енергетичного рівня; Одна комірка.
в) третього енергетичного рівня? П'ять комірок.
б) другого енергетичного рівня; Дев'ять комірок.
Енергетична комірка містить 2 електрони, тому кількість енергетичних комірок на кожному енергетичному рівні буде вдвічі меншою від максимально можливої кількості електронів на ньому.
На першому енергетичнму рівні максимально можлива кількість електронів 2, тому для розміщення цих електронів необхідна 1 комірка (2:2=1), на другому енергетичному рівні – 8, тому – необхідно 4 комірки (8:2=4), а на третьому енергетичному рівні – 18, тому – необхідно 9 комірок (18:2=9).
3. Яка кількість енергетичних комірок на підрівні s, а яка — на підрівні р? Одна і три комірки.
Енергетична комірка містить 2 електрони, тому кількість енергетичних комірок на кожному підрівні буде вдвічі меншою від максимально можливої кількості електронів на ньому.
На s–підрівні максимальна кількість електронів 2, тому для розміщення цих електронів необхідна 1 комірка (2:2)=1, а на р–підрівні – 6, тому – необхідно 3 комірки (6:2)=3.
4. Назвіть хімічний елемент, електронна формула якого має 6 s–електронів та 6 р–електронів.
Загальна кількість електронів 12 (6+6=12), тому порядковий №12 – це Магній.
5. Назвіть хімічний елемент, електронна формула якого має закінчення …3s23p4.
Елемент 3 періоду, головної підгрупи VI групи (2+4=6) – це Сульфур S.
6. В електронній оболонці атома якого хімічного елемента — Нітрогену чи Неону — усі енергетичні комірки повністю заповнені електронами?
Енергетична комірка містить 2 електрони, тому кількість заповнених енергетичних комірок для кожного хімічного елемента буде вдвічі меншою від кількості електронів (вказує порядковий номер елемента), а отриманий цілочисельний результат свідчить про те, що всі комірки повністю заповнені електронами.
В електронній оболонці Нітрогену (№7) повністю заповненими є три енергетичні комірки і одна частково (бо 7:2=3,5).
В електронній оболонці Неону (№10) повністю заповненими є п'ять енергетичних комірок (10:2=5)
7. Як змінюється графічна електронна формула атома Карбону внаслідок переходу у збуджений стан?
|
Основний стан

|
Збуджений стан

|
|
На зовнішньому
енергетичному рівні
два неспареня електрони
|
На зовнішньому
енергетичному рівні чотири
неспарених електрони
|
Зростає число неспарених електронів на зовнішьому енергетичному рівні: отримавши додатковий запас енергії, s–електрон другого енергетичного рівня переходить на р–підрівень цього самого рівня й неспарених електронів стає 4.
8. Розташуйте хімічні елементи за збільшенням числа повністю заповнених електронами енергетичних комірок.
| А Флуор |
Б Магній |
В Нітроген |
Г Оксиген |
Відповідь: В Г А Б
Міркуємо так: енергетична комірка містить 2 електрони, тому кількість заповнених енергетичних комірок для кожного хімічного елемента буде вдвічі меншою від кількості електронів (вказує порядковий номер елемента), тому достатньо розмістити елементи за зростанням їх порядкових номерів.
Застосовуємо
Вправа 42. Напишіть графічну електронну формулу атома Хлору. Скільки в ній:
а) спарених електронів; Шістнадцять.
б) неспарених електронів; Один
в) s–електронів; Шість
г) р–електронів? Одинадцять
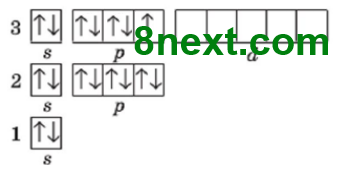
Вправа 43. Установіть відповідність між хімічними елементами та розміщенням електронів зовнішнього енергетичного рівня за енергетичними комірками.
| Хімічний елемент |
Енергетичні комірки зовнішнього рівня
дивись у підручнику
|
|
1 Оксиген
2 Фосфор
3 Берилій
4 Неон
|
А 2s2
Б 2s22р4
В 2s22р5
Г 3s23р3
Д 2s22р6
|
Відповідь: 1–Б, 2–Г, 3–А, 4–Д
Інші завдання дивись тут...