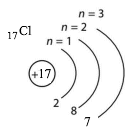Інші завдання дивись тут...
© 8next.com (відповіді, перероблене і доповнене)
• Який енергетичний рівень називають завершеним?
Зовнішній енергетичний рівень із 8 електронів називають завершеним енергетичним рівнем.
• Скільки електронів не вистачає атому Оксигену до завершення зовнішнього енергетичного рівня?
2 електронів до октету (8 електронів) не вистачає атому Оксигену для завершення зовнішнього енергетичного рівня, бо хімічний елемент Оксиген розташований в VI групі короткого варіанту періодичної таблиці.
• Наведи приклади металічних та неметалічних елементів.
Металічними є елементи: Цинк Zn, Кальцій Ca, Ферум Fe, Аурум Au, Меркурій Hg, а неметалічними – Оксиген O, Гідроген H, Карбон C, Нітроген N, Хлор Cl.
Якщо в довгій формі періодичної таблиці провести умовну лінію від Бору (B) до Астату (At), то переважно під цією лінією розміщені металічні елементи, а над нею — неметалічні елементи.
ОПРАЦЮЙ ЗРОЗУМІЙ ВИКОРИСТАЙ
Завдання 1
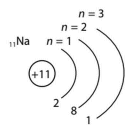
Порівняй будову атома й катіону Натрію.
| Атом Натрію Na |
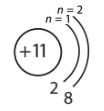
Катіон Натрію Na+ |
 |
 |
Знайди відповідь на запитання:
1 Чи змінився заряд ядра в утвореному йоні?
Заряд ядра в утвореному йоні Натрію не змінився.
2 Як змінилася кількість електронів в електронній оболонці катіону Натрію порівняно з атомом Натрію?
Атом Натрію віддав 1 електрон для завершення свого зовнішнього енергетичного рівня електронної оболонки і перетворився на катіон Натрію Na+. Кількість електронів в електронній оболонці катіону Натрію зменшилася на 1 електрон (10 електронів) порівняно з атомом Натрію (11 електронів).
3 Якого заряду набув катіон Натрію і чому саме такого?
Катіон Натрію набуває заряду +1, бо за рахунок віддачі 1 електрона зменшився негативний заряд електронної оболонки, але незмінним залишився заряд ядра, тому утворена частинка набуває позитивного заряду, величину якого визначила кількість відданих електронів (1 електрон).
Завдання 2
З’ясуй, які зміни відбуваються в електронній оболонці атома Хлору внаслідок приєднання електрона.
| Атом Хлору Cl |
Аніон Хлору Cl– |
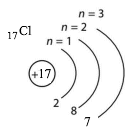 |
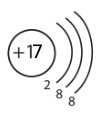 |
Крок 1 Скориставшись науковою інформацією цього параграфа, дай відповіді на запитання.
1.1 Скільки електронів має атом неметалічного елемента Хлору на зовнішньому енергетичному рівні?
Атом неметалічного елемента Хлору на зовнішньому енергетичному рівні має 7 електронів, бо хімічний елемент Cl розташовується в VII групі короткої форми періодичної таблиці.
1.2 Що енергетично вигідніше атому Хлору — віддавати чи приєднувати електрони під час утворення хімічного зв’язку з металічним елементом? Поясни, чому.
Атому Хлору енергетично вигідніше приєднати 1 електрон, щоб досягнути завершеного зовнішнього енергетичного рівня (8 електронів), адже на зовнішньому енергетичному рівні має 7 електронів.
1.3 Як називається частинка, на яку перетворився атом Хлору, приєднавши електрон? Чи змінився заряд ядра в ній порівняно із зарядом ядра атома Хлору?
Атом Хлору, приєднуючи електрон, перетворюється на аніон Хлору Cl–. Аніон Хлору набуває заряду –1, бо за рахунок приєднання 1 електрона збільшився негативний заряд електронної оболонки, але незмінним залишився заряд ядра, тому утворена частинка набуває негативного заряду, величину якого визначила кількість приєднаних електронів (1 електрон).
Крок 2 Порівняй склад електронної оболонки атома й утвореного йону і дай відповіді на запитання:
2.1 Яких змін зазнала електронна оболонка атома?
Атом Хлору, приєднуючи електрон, перетворюється на аніон Хлору Cl–, в якого зовнішній енергетичний рівень завершений і містить 8 електронів.
2.2 Якого заряду набула утворена частинка Хлору і чому саме такого?
Аніон Хлору набув заряду –1, бо утворюється приєднанням одного електрона.
Крок 3 Сформулюй висновок, чому для завершення зовнішнього енергетичного рівня Хлор приєднав 1 електрон.
Атом Хлору приєднав 1 електрон, щоб його зовнішнй енергетичний рівень був завершеним (8 електронів), як в атомі найближчого інертного елемента.
ТОБІ ДО СНАГИ
Вправа 1
Сформулюй визначення понять: йон, катіон, аніон.
Йон — заряджена частинка, яка утворюється з атома внаслідок втрати або приєднання ним одного чи кількох електронів.
Катіон — позитивно заряджений йон.
Аніон — негативно заряджений йон.
Вправа 2
Поясни, звідки з’явився заряд у катіона Натрію і чому його не було в атома Натрію.
Катіон Натрію набуває заряду, бо за рахунок віддачі 1 електрона зменшився негативний заряд електронної оболонки, але незмінним залишився заряд ядра, тому утворена частинка набуває позитивного заряду +1. Атом Натрію не має заряду, бо є електронейтральним, адже має однакову кількість протонів і електронів, тому позитивний заряд ядра дорівнює негативному заряду електронної оболонки.
Вправа 3
За наведеними у тексті параграфа зразками склади схеми перетворення атомів Магнію й Алюмінію на катіони, визнач та обґрунтуй знак і величину заряду кожного йона.
Mg – 2e = Mg2+
Катіон Магнію набуває заряду, бо за рахунок віддачі 2 електронів зменшився негативний заряд електронної оболонки, але незмінним залишився заряд ядра, тому утворена частинка набуває позитивного заряду +2.
Вправа 4
Склади схему перетворення атома Сульфуру на аніон, визнач та обґрунтуй знак і величину заряду йона.
S + 2e = S2–
Аніон Сульфуру набуває заряду, бо за рахунок приєднання 2 електронів збільшився негативний заряд електронної оболонки, але незмінним залишився заряд ядра, тому утворена частинка набуває негативного заряду –2.
Вправа 5
Використай слова «позитивний», «негативний», «катода», «анода» для заповнення пропусків у реченні:
Катіони мають позитивний заряд і в електричному полі рухаються до катода.
Аніони мають негативний заряд і в електричному полі рухаються до анода.
Вправа 6
Застосуй теорію хімічного зв’язку для пояснення кількісного складу молекули води.
У молекулі води хімічний зв’язок утворюється між атомами різних неметалічних елементів — Гідрогену й Оксигену. Кожен з двох атомів Гідрогену має 1 неспарений електрон на зовнішньому енергетичному рівні, а атом Оксигену має 2 неспарених електрони. Хімічний зв'язок в молекулі води утворюється за рахунок двох неспарених електронів атома Оксигену з неспареним електроном двох атомів Гідрогену.
________________ у виданні 2016 року _________________
§18 Природа хімічного зв'язку й електронегативність елементів
Знаємо, розуміємо
1. Сформулюйте визначення:
а) хімічного зв’язку;
Хімічний зв’язок — це взаємодія між структурними частинками (атомами, молекулами, йонами) речовини, що утримує їх разом і забезпечує існування речовин із чітко визначеним складом.
б) електронегативності;
Електронегативність — властивість атомів хімічного елемента притягувати до себе спільні з іншим атомом електронні пари.
в) завершеного енергетичного рівня.
Завершеним зовнішнім енергетичним рівнем називається енергетичний рівень з 8 електронів (для Гідрогену та Гелію — із двох).
2. Розкажіть, у який спосіб структурні частинки речовини можуть набувати завершеності зовнішнього енергетичного рівня. У три способи:
1) віддаючи електрони;
2) приєднуючи електрони;
3) утворюючи спільні електронні пари.
Від чого це залежить? У способі 1) і 2) від кількості електронів на зовнішньому енергетичному рівні атомів цих елементів, а у способі 3) від кількості неспарених електронів в електронній оболонці атома.
3. Зазначте, який із двох елементів більш електронегативний:
а) Нітроген й Оксиген;
б) Нітроген і Гідроген;
в) Нітроген і Літій.
У кожному періоді електронегативність атомів зі збільшенням заряду ядра зростає.
Застосовуємо
Вправа 52. У якій з молекул: а) кисню; б) води; в) водню; г) гідроген броміду — спільні електрони будуть зміщені до одного з атомів і чому? Бо різною є електронегативність атомів різних хімічних елементів у цих молекулах.
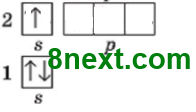
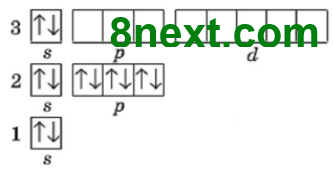
Вправа 53. Зазначте пару елементів, що мають однакову кількість неспарених електронів на зовнішньому енергетичному рівні: а) Li i S; б) Mg i F; в) Li i F. Поясніть свій вибір, скориставшись графічними електронними формулами.
a)
|
Літій Li,
1 неспарений електрон
|
Сульфур S,
2 неспарені електрони
|
 |
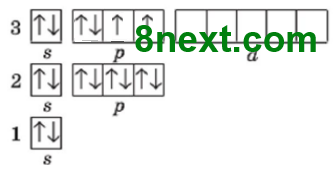 |
б)
|
Магній Mg,
0 неспарених електронів
|
Флуор F,
1 несперений електрон
|
 |
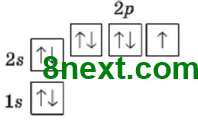 |
в)
|
Літій,
1 неспарений електрон
|
Флуор,
1 неспарений електрон
|
 |
 |
Вправа 54. Запишіть символи наведених хімічних елементів за зростанням їх електронегативності: Алюміній, Сульфур, Карбон, Гідроген.
Дивись ряд електронегативності у підручнику (Al<H<C<S).
Вправа 56. Поясніть, чому електронегативність атомів інертних елементів дорівнює нулю. Бо електронні оболонки атомів інертних елементів мають завершений зовнішній енергетичний рівень, всі електрони спарені і "чужі" електрони їм не потрібні, тому електронегативність атомів цих елементів дорівнює нулю.
Інші завдання дивись тут...