© 8next.com (відповіді, перероблене і доповнене)
| Карбон | 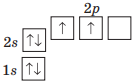 |
4 електрони |
| Нітроген | 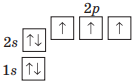 |
5 електронів |
| Оксиген | 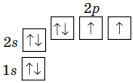 |
6 електронів |
| Флуор | 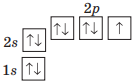 |
7 електронів |
| Неон | 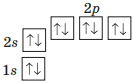 |
8 електронів |
ОПРАЦЮЙ ЗРОЗУМІЙ ВИКОРИСТАЙ
|
Речовина
|
Молеку- лярна формула |
Електронна формула |
Схема утворення молекул |
| кисень | O2 | ||
| азот | N2 |  |
|
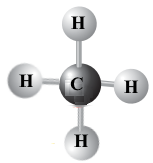
| метан | CH4 | 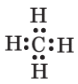 |
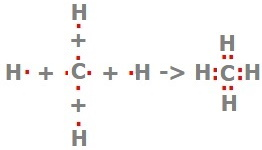 |
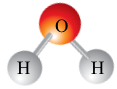
| вода | H2O | 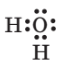 |
| кисень | азот | метан | вода |
 |
 |
Завдання 3
Вправа 1
Вправа 3
Вправа 4
Вправа 5
|
Речовина
|
Молеку- лярна формула |
Електронна формула |
Схема утворення молекул |
| аміак | NH3 | 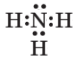 |
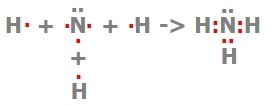 |
|
гідроген сульфіду |
H2S |
Вправа 6
| А H2O | Б CH4 | В HF | Г NH3 |
Відповідь: ВАГБ
Вправа 7
Вправа 8
§19 Ковалентний зв'язок, його утворення й види
Знаємо, розуміємо
1. Дайте визначення ковалентного зв’язку, наведіть приклади сполук із ковалентним полярним і ковалентним неполярним зв’язками.
Хімічний зв’язок за допомогою спільних електронних пар називається ковалентним.
|
Сполуки з ковалентним неполярним зв'язком |
Сполуки з ковалентним полярним зв'язком |
| H2, O2, N2, O3, Cl2, PH3 | H2O, HCl, HBr, CH4, CO2, SO2 |
Зверніть увагу, що ковалентний неполярний зв'язок виникає не тільки між однаковими елементами, але й між різними, що мають однакову електронегативність. Прикладом такого зв'язку є сполука РН3.
2. Поясніть утворення: ковалентного неполярного зв’язку та ковалентного полярного зв’язку в наведених вами прикладах.
Ковалентний неполярний зв'язок виникає між атомами хімічних елементів з однаковою електронегативністю, тому ядра обох атомів мають однаковий вплив на спільну електронну пару і вона рівновіддалена від центрів ядер обох атомів.
Ковалентний полярний зв'язок виникає між атомами хімічних елементів з різною електронегативністю, тому ядра обох атомів мають неоднаковий вплив на спільну електронну пару і вона зміщується в бік атома елемента з більшою електронегативністю.
3. На прикладі елементів 2 періоду поясніть, як змінюється електронегативність атомів хімічних елементів у межах періоду.
Зі зростанням величини заряду ядра атома (порядкового номера елемента) зростає число електронів на зовнішньому енергетичному рівні. Завершенність енергетичних рівнів атомів елементів на початку періоду (наприклад, у Літію) досягається віддачею електронів, а наприкінці періоду (наприклад, у Флуору) приєднанням електронів. Величину, яка характеризує здатність атома приєднувати електрони, називають електронегативністю. Тому найбільшу електронегативність має атом Флуору, за ним – Оксигену, потім Нітрогену. Отже, у кожному періоді електронегативність атома зі збільшенням порядкового номера елемента зростає.
4. На прикладі елементів VII групи головної підгрупи поясніть, як змінюється електронегативність атомів хімічних елементів у межах головних підгруп. Зі зростанням величини заряду ядра атома (порядкового номера елемента) зростає кількість енергетичних рівнів. Що більшою є кількість енергетичних рівнів, то більший радіус атома. Зменшення радіуса атомів пояснюється зростанням притягування зовнішніх електронів до ядра. Найменший радіус у атома Флуору. Величину, яка характеризує здатність атома приєднувати електрони, називають електронегативністю. Тому найбільшу електронегативність має атом Флуору, за ним – Хлору, потім Брому. Отже, у кожній групі головної підгрупи електронегативність атома зі збільшенням порядкового номера елемента спадає.
5. Поміркуйте, чи здатні атоми Неону до утворення ковалентних зв’язків. Ні, не здатні. Ковалентний зв'язок – це один з видів хімічного зв'язку. Коли атом якого–небудь хімічного елемента утворює хімічний зв’язок з іншим атомом, його зовнішній енергетичний рівень стає завершеним. А зовнішній енергетичний рівень атома Неону вже є завершеним, тому він не здатний до утворення хімічних зв'язків.
Застосовуємо
Вправа 57. Складіть схеми утворення молекули азоту, леткої сполуки Нітрогену з Гідрогеном.
Зазначте вид ковалентного зв’язку, кількість спільних електронних пар у кожній з них, напишіть електронні формули молекул цих речовин.
|
схеми утворення молекули
|
вид ковалентного зв’язку |
всього спільних пар |
електронні формули молекул |
|
|
неполярний | 3 |
|
|
|
полярний | 3 |
|
Вправа 58. Розташуйте формули летких сполук елементів із Гідрогеном за збільшенням кількості спільних електронних пар у молекулі.
|
А H2O 2 пари |
Б CH4 4 пари |
В HF 1 пара |
Г NH3 3 пари |
Відповідь: ВАГБ
Вправа 59. Користуючись рядом електронегативності, напишіть формулу бінарної сполуки Карбону (IV) із Сульфуром. Поясніть, як утворився хімічний зв’язок у цій сполуці, зазначте його вид.
|
формула бінарної сполуки |
схеми утворення молекули |
вид ковалентного зв’язку |
| CIVS2II |
|
неполярний |
Електронегативності елементів однакові (2,5), тому ковалентний зв'язок неполярний.
Вправа 60. Висловіть судження, чому атоми металічних елементів, на відміну від неметалічних, не утворюють спільних електронних пар. Завдяки утворенню хімічних зв’язків досягається завершеність зовнішнього енергетичного рівня атома. Атомам, які на зовнішньому енергетичному рівні мають мало електронів, енергетично вигідніше їх віддати, ніж приєднати в кількості необхідній для утворення завершеного зовнішнього енергетичного рівня. Таким чином хімічний зв'язок утворюється способом втрати електронів, а не утворенням спільних електронних пар.