Завдання 1. Зазначте, який вид хімічного зв’язку в молекулі води.
А йонний
Б ковалентний полярний
В ковалентний неполярний
Г металічний
Молекула води Н2О має ковалентним полярний хімічний зв'язок, бо утворена неметалічними елементами з різною електронегативністю.
Завдання 2. Формули речовин — Н2, N2, О2, F2, PН3, CH4, HCl, H2O — розподіліть на групи формул:
а) з однією спільною електронною парою в молекулі;
Н2, F2, HCl
б) із двома спільними електронними парами в молекулі;
О2, H2O
в) із трьома спільними електронними парами в молекулі.
N2, PH3
Завдання 3. Речовина силан SiH4 — газоподібна, погано розчинна у воді. Поміркуйте та підготуйте відповіді на запитання щодо цієї речовини.
1. Які ступені окиснення атомів у молекулі? Зробіть відповідні записи. Si+4H-
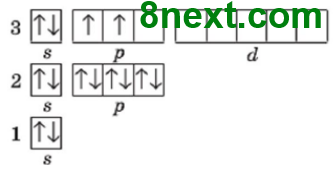
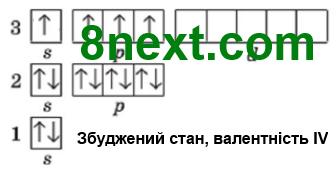
2. Скільки неспарених електронів в електронній оболонці атома Силіцію? Два електрони в основному стані і чотири - у збудженому стані.
|
Силіцій S
|
Силіцій Si*
|
3. Який вид хімічного зв’язку в молекулі? Ковалентний полярний.
Силіцій і Гідроген - неметалічні елементи з різною електронегативністю.
4. Яке число спільних електронних пар утворює атом Силіцію з атомами Гідрогену в молекулі силану SiH4? Чотири.
H H
: │
H:Si:H або Н―Si―H
: │
H H
5. За рахунок чого в атома Силіцію змінилась кількість неспарених електронів? За рахунок перебування атома у збудженому стані. Під впливом додаткової енергії, один електрон з s-орбіталі переходить на вільну р-орбіталь і на зовнішньому енергетичному рівні Силіцію стає чотири неспарених електрони.
Завдання 4. Закінчіть схеми перетворень нейтральних атомів на йони.
|
а) Cu0 – 1e -> Cu+ б) Cu0 – 2e -> Cu2+ |
в) F0 + 1e -> Cu- г) S0 + 2e -> S2- |
Завдання 5. Які частинки перебувають у вузлах кристалічних ґраток:
а) води; Молекули Н2О, бо вода має молекулярну кристалічну ґратку.
б) графіту; Атоми Карбону, бо графіт має атомну кристалічну ґратку.
в) калій оксиду; Йони (катіони К+ і аніони О2-), бо оксид має йонну кристалічну ґратку.
г) йоду? Молекули І2, бо йод має молекулярну кристалічну ґратку.
Завдання 6. В електронній оболонці атома хімічного елемента 6 s-електронів і 9 p-електронів. Який вид хімічного зв’язку в атомів цього елемента у сполуці з Гідрогеном? Електронна оболонка атома містить 15 електронів (6+9=15), тому порядковий номер хімічного елемента №15 - це Фосфор. Фосфор і Гідроген - неметалічні елементи, що мають однакову електронегативність, тому хімічний зв'язок у цій сполуці - ковалентний неполярний.
Завдання 7. Спрогнозуйте вид хімічного зв’язку між атомами з такими електронними формулами зовнішнього енергетичного рівня: …3s1 і …3s23p4. Йонний хімічний зв'язок.
Запис ...3s1 означає, що електронна оболонка атома елемента має три енергетичні рівні, тому хімічний елемент перебуває у 3 періоді, на останньому енергетичному рівні якого міститься 1 електрон, тому є елементом І групи, отже, це Натрій - металічний елемент.
Запис ...3s23p4 означає, що електронна оболонка атома елемента має три енергетичні рівні, тому хімічний елемент перебуває у 3 періоді, на останньому енергетичному рівні якого міститься 6 електронів (2+4=6), тому є елементом VІ групи, отже, це Сульфур - неметалічний елемент.
Між атомами металічних і неметалічнх елементів виникає йонний хімічний зв'язок.
Напишіть схему утворення хімічного зв’язку.
┌— 2ē —┐
│ ↓
2Na + S = Na2S
Завдання 8. Укажіть тип кристалічних ґраток у бінарній сполуці елементів із протонними числами 3 і 17.
А атомні
Б молекулярні
В йонні
Г металічні
Протонне число 3 має типовий металічний елемент Літій, що відноситься до родини лужних елементів, а протонне число 17 - типовий неметалічний елемент Хлор, що відноситься до родини галогенів. Між атомами типових металічних і неметалічних елементів виникає йонний хімічний зв'язок, тому кристалічні ґратки бінарної сполуки - йонні.
Завдання 9. Розташуйте формули оксидів за збільшенням ступеня окиснення елементів.
А B2O3
Б N2O5
В Cs2O
Г MnO2
Відповідь: В А Г Б.
Визначимо ступені окиснення елементів у сполуках:
B3+2O3-2, N2+5O5-2, Cs2+1O-2, Mn+4O2-2 і розташуємо формули за збільшенням ступенів окиснення елементів: Cs2O, B2O3, MnO2, N2O5.
Завдання 10. Зазначте пари структурних частинок речовини, з якими йон Магнію має однакову електронну будову.
А атом Аргону й катіон Калію
Б атом Неону й катіон Алюмінію
В атом Гелію й катіон Натрію
Г атом Неону й аніон Флуору
Запишемо електронні формули структурних частинок і порівняємо їх:
Mg2+ 1s22s22p6
А Ar0 1s22s22p63s23p6 й K+ 1s22s22p63s23p6
Б Ne0 1s22s22p6 й Al3+ 1s22s22p6
B He0 1s2 й Na+ 1s22s22p6
Г Ne0 1s22s22p6 й F- 1s22s22p6