Інші практичні роботи дивись тут...
ПРАКТИЧНА РОБОТА №5
РОЗПІЗНАВАННЯ ОКСИГЕНОВМІСНИХ ОРГАНІЧНИХ СПОЛУК
Усі оксигеновмісні органічні сполуки утворені трьома елементами — Карбоном, Гідрогеном і Оксигеном. У цій практичній роботі вам належить розпізнати кілька сполук, виявляючи в них функціональні групи, а також деякі властивості (наприклад, розчинність у воді). Для кожного досліду використовуйте невелику кількість речовини або розчину. Бажано, щоб певні їх порції залишилися після роботи (тоді за потреби можна повторити експеримент).
Перед виконанням завдання вирішіть:
• які хімічні реакції необхідно здійснити;
• які реактиви вам потрібні;
• що взяти для здійснення реакції — речовину чи її розчин;
• чи зашкодить досліду надлишок одного з реагентів, чи він буде необхідним;
• чи потрібне нагрівання.
Вам видано універсальні індикаторні папірці, воду, розчини лугу і солі Купруму (ІІ), спиртівку.
Завдання 1. Розпізнавання твердих речовин — крохмалю, лимонної кислоти, цукру і глюкози.
| Послідовність дій |
Спостереження | Висновок |
|
1. Розчинимо зразки твердих речовин у холодній воді, для чого до- лиємо воду у кожну пробірку зі зразками |
У трьох пробірках зразки речовин розчинилися, а в одній - ні.
|
Щоб розпізнати крохмаль від решти речовин, що перебувають у твердому стані, треба розчинити їх у холодній воді. Крохмаль у холод- ній воді не розчи- няється на відміну від решти. Отже, у цій пробірці крохмаль.
|
|
2. Перевіримо розчини у трьох пробірках, що залишилися, індикаторним папірцем |
У двох пробірках колір індикатора не змінився, а в одній пробірці змі- нився на червоний - колір кислого середо- вища. |
Водні розчини кислот змінюють забарвлення індикаторів. Оже, у цій пробірці кислота. |
|
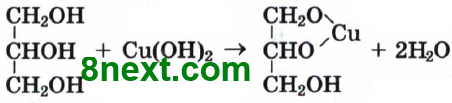
3. У дві пробірки внесемо по 1 мл лугу і 3-4 краплі купрум (ІІ) сульфату. До осаду, що утворився, додаємо по 1-2 мл розчинів, що залишилися, і пере- мішуємо.Обережно нагріваємо, але не до кипіння.
|
У двох пробірках осад розчиняється і розчин набуває яскраво-си- нього кольору, який при подальшому на- гріванні в одній із пробірок набуває оранжево-жовтого забарвлення, а зго- дом в цій пробірці випадає цегляно-чер- воний осад
|
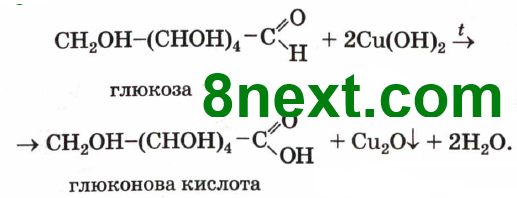
І глюкоза, і сахароза, яка входить до складу цукру, взаємодіють зі свіжоосадженим осадом Cu(OH)2, подібно до багато- атомних спиртів, з утворенням розчину яскраво- -синього кольору. Проте за наявності глюкози при подаль- шому нагріванні з'являється оранже- во-жовте забарвлення, а потім випадає цегляно-червоний осад. |
Рівняння реакцій: CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Завдання 2. Розпізнавання розчинів оцтової кислоти, етанолу, гліцерину і глюкози.
Продумайте послідовність виконання кожного завдання і складіть план. Ваші дії, спостереження, відповідні хімічні рівняння і висновки запишіть у таблицю:
| Послідовність дій | Спостереження | Висновки |
|
1. Індикаторним папірцем переві- римо середовище розчинів |
В одній із пробірок індикаторний папі- рець став червоним, що вказує на кис- лотне середовище |
Водні розчини кислот змінюють забарвлення індикаторів. Оже, у пробірці оцтова кислота |
| 2. У три пробірки
внесемо по 1 мл лугу і 3-4 краплі купрум (ІІ) суль- фату. До свіжо- осадженого осаду додаємо по 1 мл розчинів, що перевіряємо |
У двох пробірках осад розчиняється і розчин набуває яскраво-синього кольору, а в іншій осад не розчинився.
|
Одноатомні спирти не взаємодіють зі свіжо- осадженим осадом Cu(OH)2, отже, у пробірці, в якій осад не розчинився, міститься етанол
|
|
3. Обережно нагріваємо дві пробірки з розчинами яскраво-синього кольору
|
При нагріванні в одній із пробірок розчин набуває оранжево-жовтого забарвлення, а згодом в цій про- бірці випадає цегляно-червоний осад. |
У пробірці, де випав осад, міститься глюкоза, у іншій - гліцерин
|
Рівняння реакцій: CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4