АТОМНА КРИСТАЛІЧНА ҐРАТКА.
Кристалічна ґратка — модель для опису внутрішньої будови речовини, що являє собою геометрично правильне розміщення частинок, властиве речовині в кристалічному стані.
У вузлах атомних кристалічних ґраток містяться окремі атоми, сполучені між собою ковалентними зв'язками. Ковалентні зв’язки є рівноцінними та дуже міцними.
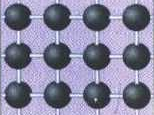
Такі кристалічні ґратки мають лише деякі речовини у твердому стані алмаз (С), силіцій (Si) , бор (В), пісок (SiO2), кремнезем (SiC), червоний фосфор, графіт (С) та ін.
Наприклад, схематична ґратка алмазу (найтвердіша природна речовина з температурою плавлення 3500 °С):
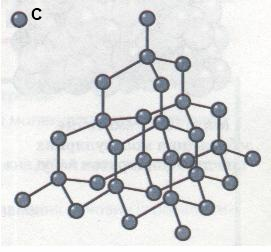

Зв’язок між типом кристалічної ґратки та фізичними властивостями речовини:
• якщо відома будова речовини, то можна прогнозувати її властивості (наприклад, чим міцніший хімічний зв'язок, що утримує частинки у вузлах кристалічних ґраток, тим міцніші кристали, тим твердіша речовина, тим вищі її температури плавлення і кипіння).
• навпаки, якщо відомі властивості речовини, то можна визначити її будову.
Фізичні властивості речовин з атомною кристалічною ґраткою:
• властива велика твердість (усі зв’язки решітки є рівноцінними та міцними);
• мають дуже високі температури плавлення і кипіння;
• нелеткі, тому не мають запаху;
• не проводять елекричний струм, або бувають напівпровідниками (бо нема вільних електронів);
• практично не розчиняються в жодних розчинниках.
МОЛЕКУЛЯРНА КРИСТАЛІЧНА ҐРАТКА.
Кристалічна ґратка — модель для опису внутрішньої будови речовини, що являє собою геометрично правильне розміщення частинок, властиве речовині в кристалічному стані.
У вузлах молекулярних кристалічних ґраток містяться молекули як неполярні, так і полярні. Частинки сполучені між собою дуже слабкими силами міжмолекулярного тяжіння.

Речовини з молекулярними кристалічними ґратками дуже поширені: йод (I2), нафтален, бром (Br2), вода (H2O), цукор, лід (H2O), спирт, хлор (Cl2), амоніак (NH,), метан (СН4) та ін.
Наприклад, схематична ґратка йоду (кристали не дуже тверді, плавляться при температурі 30 °С):
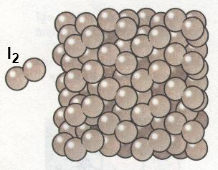

Зв’язок між типом кристалічної ґратки та фізичними властивостями речовини:
• якщо відома будова речовини, то можна прогнозувати її властивості;
• навпаки, якщо відомі властивості речовини, то можна визначити її будову.
Фізичні властивості речовин з молекулярною кристалічною ґраткою:
• невелика твердість (слабкі сили міжмолекулярного тяжіння);
• легкоплавкі речовини;
• леткі (здатність швидко випаровуватись), тому майже всі мають запах;
• не проводять елекричний струм;
• мають різну розчинність у воді.
ЙОННА КРИСТАЛІЧНА ҐРАТКА
Кристалічна ґратка — модель для опису внутрішньої будови речовини, що являє собою геометрично правильне розміщення частинок, властиве речовині в кристалічному стані.
У вузлах йонних кристалічних ґраток містяться йони, причому навколо позитивного йона розташовані негативні, а навколо негативного – позитивні. Частинки сполучені між собою досить сильним йонним зв'язком, бо протилежні частинки притягуються.

Речовини з йонними кристалічними ґратками дуже поширені: кухонна сіль (NaCl), інші солі, луги, оксиди металів, гідроксиди та ін.
Наприклад, схематична ґратка кухонної солі (кристали тверді, плавляться при температурі 801 °С):
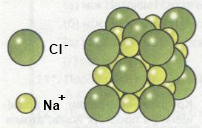

Зв’язок між типом кристалічної ґратки та фізичними властивостями речовини:
• якщо відома будова речовини, то можна прогнозувати її властивості;
• навпаки, якщо відомі властивості речовини, то можна визначити її будову.
Фізичні властивості речовин з йонною кристалічною ґраткою:
• за звичайної температури майже усі досить тверді, крихкі (сильний зв'язок між протилежно зарядженими частинками), ;
• температура плавлення досить висока;
• нелеткі, тому не мають запаху;
• йонні сполуки в цілому нейтральні, не проводять електричний струм, проте розчини таких речовин проводять елекричний струм;
• мають різну розчинність.
План.
1. Атомна кристалічна ґратка.
2. Молекулярна кристалічна ґратка.
3. Йонна кристалічна ґратка.
Використана література.
Універсальний довідник школяра. Тернопіль: Навчальна книга «Богдан», 2005
Хімія 8 клас. Буринська Н.М., Київ: Перун, 2008
Хімія 8 клас. Дячук Л.С., Гладюк М.М., Тернопіль: Навчальна книга «Богдан», 2016
Інтернет
ЗАВАНТАЖИТИ/СКАЧАТИ (Скачать) реферат у форматі DOC