Вправа 1 Яка хімічна формула фенолу? C6H5OH
Вправа 2 Як взаємовпливають вуглеводневий замісник і характеристична група в молекулі фенолу? Електрони бензенового кільця вступають у взаємодію з неподіленою електронною парою атома Оксигену, залучають її до своєї сфери й відтягують на себе. Унаслідок цього полярність зв’язку О–Н збільшується, а на атомах Карбону в положеннях 2, 4, 6 відносно атома Карбону, сполученого з гідроксильною групою, накопичуються часткові негативні заряди:
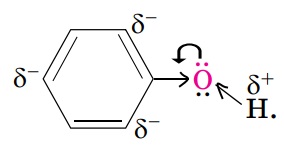
Це спричиняє підвищену рухливість атома Гідрогену гідроксильної групи і атомів Гідрогену бензенового кільця біля атомів Карбону в положеннях 2, 4, 6 відносно атома Карбону, сполученого з гідроксильною групою, що заміщуються на інші атоми під час хімічних реакцій
Вправа 3 Які зв’язки утворюються між молекулами фенолу? Водневі зв'язки
Вправа 4 Які фізичні властивості фенолу? Фенол – кристалічна безбарвна легкоплавка (t пл.=42 °С) летка речовина з характерним різким запахом. Фенол помірно розчиняється в холодній воді й необмежено — в гарячій
Вправа 5 З якими речовинами реагує фенол? З бромною водою, лужними металами, лугами
До яких типів належать ці реакції? Заміщення, нейтралізація
Вправа 6 Чим фенол шкідливий для здоров’я людини й довкілля? Фенол - їдка отруйна речовина. Потрапляння фенолу на шкіру призводить до хімічних опіків, негативно впливає на шлунково-кишковий тракт, органи дихання, спричиняє порушення нервової системи. Фенол разом з іншими промисловими викидами потрапляє в стічні води, в атмосферу, забруднюючи навколишнє довкілля, завдає серйозної шкоди рослинному і тваринному світу, здоров'ю людей
Вправа 7 Порівняйте будову й властивості:
а) бензену й фенолу
| Порівняння | Бензен | Фенол |
| Агрегатний стан | рідкий | твердий |
|
Температура плавлення |
5,5 0С | 42 0С |
|
Температура кипіння |
80,1 0С | 187,9 0С |
| Колір, запах |
безбарвний, різкий |
безбарвний, характерний |
|
Хімічні властивості
|
повне окиснення, гідрування, хлорування
|
реагує з бромною водою, лужними металами, лугами, легко окиснюється повітрям |
б) етанолу й фенолу
| Порівняння | Етанол | Фенол |
| Агрегатний стан | рідкий | твердий |
|
Температура плавлення |
-114,40С | 420С |
|
Температура кипіння |
78,30С | 181,9 0С |
|
Колір, запах |
безбарвний, специфічний |
безбарвний, характерний |
|
Хімічні властивості |
реагує з лужними металами, здатний до дегідратації й окиснен- ня, є горючою речови- ною |
реагує з бромною водою, лужними металами, лугами, легко окиснюється повітрям |
Вправа 9 Поясніть, чому:
а) нині відповідальні виробники не використовують фенол як консервант гуаші для дитячої творчості; Фенол дуже токсичний
б) фенол, що потрапив на шкіру, потрібно змивати гліцеролом; Фенол добре розчиняється в багатьох органічних розчинниках
в) у водоймах, забруднених фенолом, різко зменшується вміст кисню, що негативно впливає на життєдіяльність організмів; У холодній воді фенол розчиняється обмежено із утворенням емульсії
г) хлорування води, що містить домішки фенолу в безпечній концентрації (ГДК 0,001 мг/мл), робить її непридатною для вживання; Фенол взаємодіє з хлором з утворенням хлороводню, водний розчин якого є кислотою
д) один з етапів знешкодження токсичних ґрунтів, забруднених фенолом, полягає в тому, що ґрунт змішують з водою і подрібненим негашеним вапном. Реакція взаємодії негашеного вапна (СаО) з водою є процесом гашення вапна, а кальцій гідроксид (гашене вапно) - сильна основа, виявляє всі властиваості лугів, реагує з фенолом з утворенням солі та води
Вправа *10 Які слова пропущено в наведеному описі: «Спрощена технологічна схема знефенолювання стічних вод коксохімічних заводів така: фенольні стічні води обробляють бензеном, фенол з води переходить у бензен, бо фенол розчиняється в ньому. Бензеновий розчин відокремлюють і обробляють водним розчином натрій гідроксиду. Унаслідок цього утворюється натрій фенолят, який добре розчиняється у воді. Після оброблення відокремленого від бензену водного розчину фенолу карбон (IV) оксидом утворюється водна емульсія фенолу, яку відокремлюють»?
Вправа *11 «У сучасній косметології розчин фенолу невеликої концентрації використовують для омолодження шкіри обличчя. Він проникає до глибоких шарів дерми, і відбувається інтенсивне руйнування старих колагенових волокон та еластину, на зміну яким клітини починають активно виробляти нові волокна: шкіра підтягується, зникають глибокі зморшки». Оцініть достовірність цього рекламного повідомлення. Наведіть, з погляду хімії, аргументи на підтвердження ефективності цієї процедури. Фенол зумовлює денатурацію білків.
Поясніть, яку небезпеку вона може становити для здоров’я людини, що її проходить. Можна отримати хімічні опіки
Вправа 12 Обчисліть об’єм (л) водню (н. у.), що утвориться внаслідок взаємодії натрію масою 2,3 г з фенолом, узятим у надлишку.
Відомо: m(Na)=2,3 г
Знайти: V(H2)-?
Розв'язування
M(Na)=23 г/моль
n(Na)=m(Na):M(Na)=2,3 г: 23 г/моль=0,1 моль
Записуємо хімічне рівняння: С6H5OH + Na = C6H5ONa + H2↑
За рівнянням реакції n(Na):n(H2)=1:1, тому n(H2)=n(Na)=0,1 моль
V(H2)=n(H2)•Vm=0,1 моль•22,4 л/моль=2,24 л
Відровідь: 2,24 л
Вправа 13 Обчисліть масу (г) осаду, що утвориться внаслідок дії бромної води, узятої в надлишку, на водну емульсію, яка містить фенол масою 9,4 г.
Відомо: m(С6H5OH)=9,4 г
Знайти: V(C6H2Br3OH)-?
Розв'язування
M(C6H5OH)=94 г/моль
n(C6H5OH)=m(C6H5OH):M(C6H5OH)=9,4 г: 94 г/моль=0,1 моль
Записуємо хімічне рівняння: С6H5OH + 3Br2 = C6H2Br3OH↓ + 3HBr
За рівнянням реакції n(C6H5OH):n(C6H2Br3OH)=1:1, тому
n(C6H2Br3OH)=n(C6H5OH)=0,1 моль
M(C6H2Br3OH)=331 г/моль
m(C6H2Br3OH)=n(C6H2Br3OH)●M(C6H2Br3OH)=0,1 моль●331 г/моль = 33,1 г
Відровідь: 33,1 г
Вправа 14 У питній воді виявлено сліди токсичної речовини. Шляхом якісного та кількісного аналізу встановлено, що це – похідна фенолу такого складу: ω(C)=36,5%, ω(H)=1,5%, ω(O)=8%, ω(Cl)=54%. Відносна густина її пари за воднем становить 98,75. Визначте молекулярну формулу цієї речовини.
Відомо: DH2(CxHyOzClp)=98,75, ω(C)=36,5%, ω(H)=1,5 %, ω(O)=8%, ω(Cl)=54%
Знайти: СхНуOzClp-?
Розв'язування
І спосіб
Mr(CхHуOzClp)=DН2(CхHуOzClp)•Mr(Н2)=98,75•2=197,5
З формули обчислення масової частки елемента у сполуці знаходимо число атомів:
х=ω(С)•Mr(CxHyOzClp):Ar(C)=0,365•197,5:12=6
у=ω(Н)•Mr(CxHyOzClp):Ar(Н)=0,015•197,5:1=3
z=ω(O)•Mr(CxHyOzClp):Ar(O)=0,08•197,5:16=1
p=ω(Cl)•Mr(CxHyOzClp):Ar(Cl)=0,54•197,5:35,5=3
Отже, формула вуглеводню С6Н3OCl3, або C6H2Cl3OH
ІІ спосіб
Нехай маса сполуки 100 г. Тоді маса Карбону в ньому 36,5 г, Гідрогену - 1,5 г, Оксигену - 8 г, а Хлору 54 г.
1. Обчислюємо кількість речовини кожного з хімічних елементів у сполуці масою 100 г:
n(С)=m(C):M(C)=36,5 г : 12 г/моль=3 моль
n(H)=m(Н):М(H)=1,5 г : 1 г/моль=1,5 моль
n(O)=m(O):М(O)=8 г : 16 г/моль=0,5 моль
n(Cl)=m(Cl):М(Cl)=54 г : 35,5 г/моль=1,5 моль
2. Знаходимо кількісні співвідношення індексів у найпростішій формулі:
n(C):n(H):n(O):n(Cl)=3:1,5:0,5:1,5
Якщо співвідношення між атомами виражене не цілими, а дробовими числами, то вважаємо, що менше число дорівнює одиниці, а більше число ділимо на нього. Тоді
n(C):n(H):n(O):n(Cl)=3/0,5 : 1,5/0,5 : 0,5/0,5 : 1,5/0,5=6:3:1:3, отже, найпростіша формула C6H3OCl3
3. Уточнюємо істинну формулу:
Mr(CхHуOzClp)=DН2(CхHуOzClp)•Mr(Н2)=98,75•2=197,5
Mr(C6H3OCl3)=197,5 Oтже, найпростіша формула речовини збігається з її істинною (молекулярною) формулою
Відповідь:C6H3OCl3, або C6H2Cl3OH