![]()
I-ІІ рівні
Вправа 1 Поясніть утворення ковалентних зв'язків:
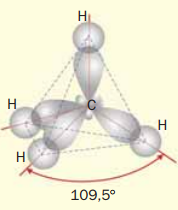
І варіант - у молекулі метану;
Ковалентні зв’язки утворюються за рахунок одного s- і трьох р-електронів атома Карбону, який перебуває у збудженому стані, й s-електронів атомів Гідрогену.
Довжина зв'язку С-—С 0,154 нм
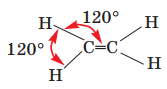
ІІ варіант - у молекулі етену;
Два неспарених електрони кожного атома Карбону беруть участь в утворенні двох спільних електронних пар; виникає подвійний зв’язок С=С. Інші два електрони кожного атома Карбону утворюють спільні електронні пари з двома атомами Гідрогену, внаслідок чого реалізуються прості ковалентні зв’язки С–Н.
Довжина зв'язку С=С 0,134 нм
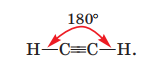
ІІІ варіант - у молекулі етину. Нарисуйте моделі молекул, позначивши довжину зв'язку та валентний кут.
Три неспарених електрони кожного атома Карбону беруть участь в утворенні трьох спільних електронних пар; виникає потрійний зв’язок С≡С. Один електрон кожного атома Карбону утворює спільну електронну пару з атомом Гідрогену, внаслідок чого реалізується простий ковалентний зв’язок С–Н.
Довжина зв'язку С≡С 0,120 нм
Вправа 2 Охарактеризуйте хімічні властивості метану, етену та етину та поясніть, як вони пов'язані з будовою їх молекул.
Властивості метану
Метану, як наасиченим вуглеводням, властиві реакції заміщення.
Властивості етену
Етину, як ненасиченим вуглеводням, властиві реакції приєднання за місцем розриву подвійного зв'язку
Властивості етину
Етину, як ненасиченим вуглеводням, властиві реакції приєднання за місцем розриву потрійного зв'язку
IІІ рівень
Вправа З Етанову кислоту повністю нейтралізували розчином калій гідроксиду, що містив 11,2 г пугу. Обчисліть маси продуктів реакції.
Відомо: m(KOH)=11,2 г
Знайти: m(CH3COOH)-?, m(CaCO3)-?
Розв'язування
Записуємо рівняння реакції:
11,2 г х г у г
СН3СООН + KOH → СН3СООK + H2O
56 г 98 г 18 г
Mr(KOH)=Ar(K)+Ar(O)+Ar(H)=39+16+1=56,
М(KOH)=56 г/моль, маса 1 моль=56 г
Mr(CH3CООK)=2•Ar(C)+3•Ar(H)+2•Ar(О)+Ar(K)=2•12+3•1+2•16+39=98,
М(CH3COOK)=98 г/моль, маса 1 моль=98 г
Mr(H2O)=2•Ar(H)+Ar(O)=2•1+16=18,
М(H2O)=18 г/моль, маса 1 моль=18 г
х=m(СН3СOOК)=11,2 г • 98 г : 56 г=19,6 г
у=m(Н2О)=11,2 г • 18 г : 56 г=3,6 г
Відповідь: 19,6 г CH3COOК i 3,6 г Н2О
ІV рівень
Вправа 4 Суміш етану з етином об'ємом 120 л (н.у.) з об'ємною частою етину 28% піддали дії хлору. Обчисліть об'єм хлору, що вступив у реакцію, та масу утвореного продукту.
Відомо: V(суміші)=120 л, φ(С2Н2)=28%
Знайти: V(Cl2)-?, m(C2H2Cl4)-?, m(повітря)-?
Розв'язуванння
V(C2H2)=(φ(С2Н2)•V(суміші)):100%=(28%•120 л):100%=33,6 л
φ(C2H6)=100%-φ(С2Н4)=100%-28%=72%
V(C2H6)=(φ(С2Н6)•V(суміші)):100%=(72%•120 л):100%=86,4 л
Записуємо рівняння реакцій хлорування етину:
33,6 л х л у г
C2H2 + 2Cl2 -> C2H2Cl4
22,4 л 44,8 л 168 г
За н.у. 1 моль газу займає об'єм 22,4 л, а 2 моль займуть 44,8 л
М(C2H2Cl4)=168 г/моль, маса 1 моль=168 г
х=V1(Cl2)=33,6 л • 44,8 л : 22,4 л=67,2 л
у=m(C2H2Cl4)=33,6 л • 168 г : 22,4 л=252 г
Записуємо рівняння реакцій хлорування етану:
67,2 л х л у г z г
C2H6 + 6Cl2 -> C2Cl6 + 6HCl
22,4 л 134,4 л 237 г 219 г
За н.у. 1 моль газу займає об'єм 22,4 л, а 6 моль займуть 134,4 л
М(C2Cl6)=237 г/моль, маса 1 моль=237 г
М(HCl)=36,5 г/моль, маса 1 моль=36,5 г, маса 6 моль=219 г
х=V2(Cl2)=67,2 л • 134,4 л : 22,4 л=403,2 л
у=m(C2Cl6)=67,2 л • 237 г : 22,4 л=711 г
z=m(HCl)=67,2 л • 219 г : 22,4 л=657 г
Розраховуємо сумарний об'єм хлору:
V(Cl2)=V1(Cl2)+V2(Cl2)=67,2 л + 403,2 л=470,4 л
Відповідь: 470,4 л хлору; 252 г 1,1,2,2-тетрахлороетану;
711 г тетрахлороетану і 657 г хлороводню