![]()
І рівень
Вправа 1 Назвіть відомі вам полімери, синтезовані з вуглеводневої сировини. Поліетилен, поліпропілен, поліхлорвініл
Вправа 2 Сформулюйте визначення реакції полімеризації. Полімеризація — реакція утворення високомолекулярних сполук (полімерів) з низькомолекулярних (мономерів)
Вправа 3 Поліхлороетан має таку формулу (―СH2―СHCl―)n. Напишіть формулу мономера.
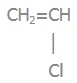
Вправа 4 Перелічіть властивості натурального та синтетичного каучуків та укажіть переваги останнього.
Властивості натурального каучука: еластичність, ізоляційні властивості, водо- й газонепроникність, зносостійкість, погана стійкість до зміни температури (із підвищенням температури він стає м’яким і липким, а в разі зниження — крихким і нееластичним).
Властивості синтетичного каучука: еластичність, ізоляційні властивості, водо- й газонепроникність, зносостійкість, стійкість до зміни температури
Переваги синтетичного каучука: стійкість до зміни температури
ІІ рівень
Вправа 1 Поясніть чим відрізняються реакції полімеризації та поліконденсації. Реакції поліконденсації відрізняються від полімеризації тим, що крім високомолекулярної сполуки утворюється й низькомолекулярна (вода, амоніак, спирт тощо).
Вправа 2 Напишіть формули двох алкадієнів, що можуть бути мономерами для синтезу каучуків. CH2=CH—CH=CH2, СH2=C(CH3)—CH=CH2
Вправа 3 Назвіть спосіб розпізнавання натурального та штучного шовку. Натуральний шовк горить, а штучний — плавиться
ІІІ рівень
Вправа 1 Назвіть сировину для синтезу волокон, напишіть формули сполук та назвіть їх.
Сировина капрону:
епсилон-амінокапронова кислота H2N—(CH2)5—COOH
Сировина нейлону:
дикарбонова адипінова кислота HOOC—(CH2)4—COOH та
гексаметилендіамін H2N—(CH2)6—NH2
Сировина лавсану:
терефталева кислота HOOC—C6H4—COOH та
етиленгліколь (етан-1,2-ол) OH—CH2—CH2—OH
Вправа 2 Класифікуйте полімери та назвіть чим вони відрізняються між собою. За структурою полімери поділяють на лінійні, розгалужені й просторові; за відношенням до температури — на термопластичні й термореактивні.
Відрізняються фізичними властивостями. Полімери лінійної структури еластичні, гнучкі, термопластичні, повільно розчиняються в деяких розчинниках з утворенням в'язких розчинів; розгалуженої — нееластичні, гнучкість зменшується із зростанням ступеня розгалуження, розчиняються погано; сітчастої — пружні, легше руйнуються, термореактивні, набухають в органічних розчинниках.
Термопластичність - це властивість тіла змінювати свою форму за нагрівання і зберігати її після охолодження.
Вправа 3 Поясніть, як практично довести, що полібутадієновий та поліізопреновий каучуки є ненасиченими полімерами. Якісною реакцією на ненасичені сполуки є їх взаємодія з бромом.
Напишіть рівняння реакції.
1) CH2=CH—CH=CH2 + Br2 -> CH2Br—CH=CH—CH2Br
1,4-дибромобут-2-ен
CH2Br—CH=CH—CH2Br + Br2 -> CH2Br—CHBr—CHBr—CH2Br
1,2,3,4-тетрабромобутан
2) CH2=C(СH3)—CH=CH2 + Br2 -> CH2Br—C(СH3)=CH—CH2Br
1,4-дибром,2-метилбут-2-ен
CH2Br—C(СH3)=CH—CH2Br + Br2 -> CH2Br—C(СH3)Br—CHBr—CH2Br
1,2,3,4-тетрабром,2-метилетан
Вправа 4 Обчисліть масу бутан-1,3-дієну та об'єм кисню (н.у.), що вступлять в реакцію горіння, якщо утворився карбон (IV) оксид кількістю речовини 2 моль.
Відомо: v(СO2)=2 моль
Знайти: m(СH2=CH—CH=CH2)-?, V(O2)-?
Розв'язування
Складаємо рівняння реакції:
х г у л 2 моль
2CH2=CH—CH=CH2 + 11O2 → 8CO2↑ + 6H2O
108 г 246,4 л 8 моль
M(CH2=CH―CH=CH2)=54 г/моль, маса 1 моль=54 г, а маса 2 моль=108 г
За н.у. 1 моль газу займає об'єм 22,4 л, а 11 моль - у 11 разів більший об'єм, тобто 246,4 л
х=2 моль • 108 г : 8 моль=27 г
у=2 моль • 246,4 л : 8 моль=61,6 л
Відповідь: 27 г бутан-1,3-дієну і 61,6 л кисню
IV рівень
Вправа 1 Напишіть реакції, що лежать в основі виробництва:
а) ізопренового каучуку, політетрафлуороетену, волокна капрон. Укажіть назви реакцій за допомогою яких їх синтезують.
Реакція полімеризації ізопренового каучука:
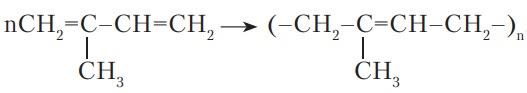
Реакція полімеризації політетрафлуороетену:
|
F F F F │ │ │ │ nC=C ->(―C―C―)n │ │ │ │ F F F F |
Реакція поліконденсації капрону:
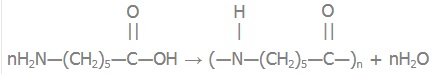
Вправа 2 Поясніть суть процесу перетворення каучуку в гуму та ебоніт.
Гуму виготовляють з вулканізованого каучуку. Суть процесу вулканізації полягає в «зшиванні» макромолекул каучуку містками з атомів Сульфуру за місцем розриву подвійних зв’язків, завдяки чому каучук стає стійким до дії температури. Ебоніт утворюється, якщо масова частка Сульфуру в складі каучуку становить 25–40%
Де застосовують ці продукти органічного синтезу.
Із гуми виготовляють покришки й камери для коліс, її застосовують для електроізоляції, промислові товари, медичні прилади, виробництва труб, взуття. Ебоніт застосовують для виготовлення гребінців, рукояток ножів, мундштуків духових музичних інструментів, прикрас
Вправа 3 У вас є волокна: вовна, натуральний шовк, ацетатне волокно, капрон. Поясніть способи їх розрізнення. Вовна і натуральний шовк горять із запахом паленого пір'я, а ацетатне волокно і капрон плавляться.
Вправа 4 Суміш вуглеводнів масою 22,4 г, що містила етан й ненасичені етен і бутан-1,3-дієн кількістю речовини по 0,2 моль, піддали дії брому в надлишку. Обчисліть, як зміниться маса суміші після реакції.
Відомо: m0(суміші)=22,4 г, v(С2Н6)=v(C2H4)=v(CH2=CH―CH=CH2)=0,2 моль
Знайти: як зміниться маса суміші-?
Розв'язування
1. Складаємо рівняння реакції бромування етену:
0,2 моль х г
C2H4 + Br2 → C2H4Br2
1 моль 188 г
M(C2H4Br2)=188 г/моль, маса 1 моль=188 г
х=0,2 моль • 188 г : 1 моль=37,6 г
2. Складаємо рівняння реакції бромування бутан-1,3-дієну:
0,2 моль х г
CH2=CH—CH=CH2 + 2Br2 → CH2Br―CHBr―CHBr―CH2Br
1 моль 374 г
M(CH2Br―CH―CH―CH2Br)=374 г/моль, маса 1 моль=374 г
х=0,2 моль • 374 г : 1 моль=74,8 г
3. Обчислюємо масу етану:
M(C2H6)=30 г/моль
m(C2H6)=v(C2H6)•M(C2H6)=0,2 моль•30 г/моль=6 г
4. Знаходимо сумарну масу суміші після реакції:
m(суміші)=m(C2H6)+m(C2H4Br2)+m(C4H6Br4)=6 г+37,6 г + 74,8 г=118,4 г
5. Знаходимо як зміниться маса суміші після реакції:
m(суміші)-m0(суміші)=118,4 г - 22,4 г=96 г
Відповідь: маса суміші після реакції збільшиться на 96 г