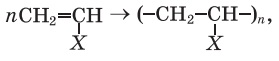![]()
І рівень
1 Дайте відповіді на тестові завдання.
Вправа 1 Укажіть дві причини різноманітності органічних речовин:
А Вступати в реакції горіння
Б Утворювати гомологічні ряди
В Широке застосування у суспільному господарстві
Г Явище ізомерії
Відповідь: БГ
Вправа 2 Позначте групу біологічно активних речовин:
А Алкани
Б Насичені одноатомні спирти
В Карбонові кислоти
Г Вітаміни
Відповідь: Г
Вправа 3 Позначте дві речовини, що можна використовувати для синтезу 1,2-дихлороетану:
А Пропен, гідроген хлорид
Б Метан, хлор
В Етен, хлор
Г Етан, гідроген хлорид
Відповідь: В
СH2=CH2 + Cl2 -> Cl—CH2—CH2—Cl
Вправа 4 Позначте групу назв, в якій вказано тільки невідновлювальні джерела енергії:
А Нафта, газ, ріпакова олія
Б Торф, солома, вугілля
В Деревина, сланці, нафта
Г Суха трава, газ тирса
Відповідь: В
Вправа 5 Укажіть належність добрива до відповідної групи:
|
А Амофоска Б Суперфосфат В Компост Г Гній |
1 Мінеральні 2 Органічні
|
Відповідь: А,Б-1; В,Г-2
Вправа 6 Укажіть належність між назвою хімікатів і застосуванням:
|
А Гербіциди Б Зооциди В Фунгіциди |
1 Боротьба з грибковими захворюваннями 2 Боротьба з бур'янами 3 Боротьба з гризунами 4 Боротьба з фітофторою |
Відповідь: А-2, Б-3, В-1
Вправа 7 Укажіть за відсутності яких вітамінів порушуються функції нервової, травної, серцево-судинної систем:
А Вітаміну С
Б Групи вітамінів В
В Вітаміну D
Г Вітаміну А
Відповідь: Б
Вправа 8 Укажіть вітамін, що добре розчиняється у воді:
А С
Б Е
В D
Г В1
Відповідь: А
Вправа 9 Позначте низку продуктів, що необхідро мінімізувати у раціоні або повністю відмовитися від них:
А Білий хліб, бобові, молоко
Б Яйця, риба, свинина
В Кондитерські вироби, майонез, маргарин
Г Яловичина, сметана, олія
Відповідь: В
ІІ рівень
Вправа 1 Як сировина для синтезу неметалічних матеріалів використовуються етен і пропен. Напишіть рівняння реакції полімеризації цих сполук у загальному вигляді:
|
де X — це H (мономером є етен, полімером — поліетилен), X — це СH3 (мономером є пропен, полімером — поліпропілен) |
Вправа 2 Напишіть рівняння реакцій за схемою:
С → CH4 → C2H2 → C6H6 → C6H12
CH4 → CO2
С + 2H2 → CH4
2CH4 → C2H2 + 3H2
3C2H2 → C6H6
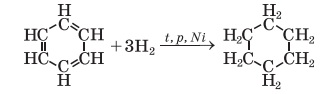
CH4 + 2O2 → CO2↑ + 2H2O
Вправа 3 Обчисліть об'єм кисню (у.н.), що витратиться на спалювання етину об'ємом 18 м3 з масовою часткою домішок 10%.
Відомо: V(С2H2 з дом.)=18 м3, ω(дом.)=10%
Знайти: V(О2)-?
Розв'язування
1. Масу чистого етину в суміші природного газу об'ємом 18 м3 можна знайти двома способами:
І спосіб
Розраховуємо масову частку чистого етину:
ω(С2Н2)=100%-ω(дом.)=100%-10%=90%
Розраховуємо об'єм чистого етину:
18 м3 становлять 100%
х м3 - 90%
х=V(C2H2)=18 м3 • 90% : 100%=16,2 м3
ІІ спосіб
Розраховуємо об'єм домішків:
18 м3 становлять 100%
х м3 - 10%
х=V(дом.)=18 м3 • 10% : 100%=1,8 м3
Розраховуємо об'єм чистого етинуі:
V(C2H2)=V(С2H2 з дом.)-V(дом.)=18 м3-1,8 м3=16,2 м3
2. Записуємо рівняння реакції спалювання етину:
16,2 м3 х м3
2C2H2 + 5O2 → 2H2O + 4CO2↑
44,8 м3 112 м3
За н.у. 1 кмоль газу займає об'єм 22,4 м3, тому 2 кмоль займуть удвічі більший об'єм, тобто 44,8 м3, а 5 кмоль - у п'ять разів більший об'єм, тобто 112 м3
х=V(О2)=16,2 м3 • 112 м3 : 44,8 м3=40,5 м3
Відповідь: 40,5 м3
ІІІ рівень
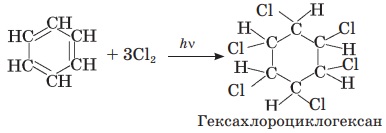
Вправа 1 Напишіть рівняння реакцій за схемою:
CH4 → C2H2 → C2H4 → C2H2 → C6H6 → C6H12 → CO2 → C6H12O6
C2H4 → (―C2H4―)n
C6H6 → C6H6Cl6
2CH4 → C2H2 + 3H2
C2H2 + H2 → C2H4
C2H4 → C2H2 + H2
3C2H2 → C6H6
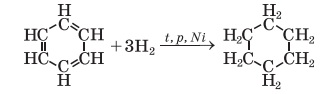
C6H12 + 9O2 → 6CO2↑ + 6H2O
6CO2 + 6H2O → C6H12O6 + 6O2↑
nC2H4 → (―CH2―CH2―)n
Вправа 2 Складіть схему, що унаочнює приклади невідновлюваних та відновлюваних джерел енергії:
|
Невідновлювані джерела енергії |
Відновлювані джерела енергії |
|
Нафта газ вугілля деревина сланці торф ядерна енергетика |
рослинна сировина (різні види біомаси, відходи виробництва і побуту), геліоенергетика (енергія Сонця), вітроенергетика, гідроенергетика
|
Вправа 3 Кальцій карбід, що є сировиною для добування етину, добувають з вапняку. Обчисліть, яку масу вапняку з масовою часткою домішок 15% потрібно взяти, щоб синтезувати бензен масою 21,2 кг.
Відомо: m(С6H6)=21,2 кг, ω(дом.)=15%
Знайти: m(CаСО3 з дом.)-?
Розв'язування
1. Записуємо рівняння реакції добування бензену з етину:
х кмоль 21,2 кг
3C2H2 -> C6H6
3 кмоль 78 кг
М(С6H6)=78 кг/кмоль, маса 1 кмоль=78 кг
х=v(C2H2)=21,2 кг • 3 кмоль : 78 кг=0,815 кмоль
2. Записуємо рівняння реакції добування етину з кальцій карбіду:
х кмоль 0,815 кмоль
CaC2 + 2H2O → Ca(OH)2 + C2H2
1 кмоль 1 кмоль
х=v(СаC2)=0,815 кмоль • 1 кмоль : 1 кмоль=0,815 кмоль
3. Записуємо рівняння реакції добування кальцій карбіду з негашеного вапна:
х кмоль 0,815 кмоль
CaO + 3C → CaC2 + CO↑
1 кмоль 1 кмоль
х=v(СаО)=0,815 кмоль • 1 кмоль : 1 кмоль=0,815 кмоль
4. Записуємо рівняння реакції добування кальцій оксиду з вапняка:
х кг 0,815 кмоль
CaСO3 → CaО + CO2↑
100 кг 1 кмоль
М(СаСО3)=100 кг/кмоль, маса 1 кмоль=100 кг
х=m(CаСО3)=0,815 кмоль • 100 кг : 1 кмоль=81,5 кг
5. Обчислюємо масову частку чистого вапняку:
ω(СаСО3)=100%-ω(дом.)=100%-15%=85%
6. Обчислюємо масу вапняку:
m(СаСО3 з дом.)=(m(СаСО3):ω(СaCO3))•100%=81,5 кг:85%•100%=95,8 кг
Відповідь: 95,8 кг
ІV рівень
Вправа 1 Напишіть рівняння реакцій за схемою: Назвіть речовини, позначені літерами.
СaCO3 = CaO + CO2↑
кальцій оксид
CaO + 3C = CaC2 + CO↑
кальцій карбід
CaC2 + 2H2O → Ca(OH)2 + C2H2
етин
3C2H2 → C6H6
бензен
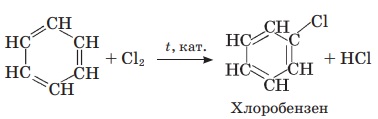
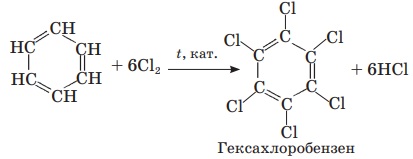
Відповідь: А-кальцій оксид, Б-кальцій карбід, В-етин, Г-бензен,
Г1-хлоробензен, Г2-гексахлоробензен
Вправа 2 У вас є етен, етаналь, етанова кислота, глюкоза і всі необхідні реактиви. Складіть самостійно план їхнього визначення, напишіть відповідні рівняння реакцій.
ПЛАН
Оскільки потрібно здійснити щонайменше три реакції, тому розділяємо вмістиме пробірок на 3 порції
1. Реактивом для виявлення етену є бромна вода. Ознака якісної реакції — знебарвлення бромної води.
CH2=CH2 + Br2 → CHBr—CHBr
2. Реактивом для виявлення етанової кислоти є індикатор, наприклад, лакмус. Ознака якісної реакції — зміна забарвлення індикатора на червоний.
3. Етаналь і глюкозу можна розпізнати за зовнішнім виглядом: перша - рідина без кольору з різким запахом, а друга — кристалічна речовина. Розпізнати за допомогою якісних реакцій не можна, бо мають однакові зовнішні ознаки реакцій при застосуванні реактивів Cu(OH)2 чи Ag2O.
Вправа 3 Етин, добутий взаємодією кальцій карбіду масою 40 г водою, пропустили через надлишок бромної води. Маса продукту реакції становила 173 г. Обчисліть масову частку домішок у карбіді.
Відомо: m(СaC2 з дом.)=40 г, m(C2H2Br4)=173 г
Знайти: ω(дом.)-?
Розв'язування
1. Записуємо рівняння реакції бромування етину:
х г 173 г
C2H2 + 2Br2 -> C2H2Br4
26 г 346
М(С2Н2)=26 г/моль, маса 1 моль=26 г
М(С2Н2Br4)=346 г/моль, маса 1 моль=346 г
х=m(C2H2)=26 г • 173 г : 346 г = 13 г
2. Записуємо рівняння реакції добування етину з кальцій карбіду:
х г 13 г
CaC2 + 2H2O -> Ca(OH)2 + C2H2
64 г 26 г
М(СaC2)=64 г/моль, маса 1 моль=64 г
х=m(СаC2)=64 г • 13 г : 26 г=32 г
3. Масу домішок в технічному кальцій карбіді масою 40 г можна знайти двома способами:
І спосіб
Обчислюємо масову частку чистого кальцій карбіду:
ω(СаС2)=(m(CаС2):m(CаС2 з дом.))•100%=(32 г:40 г)•100%=80%
Розраховуємо масову частку домішок в технічному кальцій карбіді:
ω(дом.)=100%-ω(C2H2)=100%-80%=20%
ІІ спосіб
Розраховуємо масу домішок в технічному кальцій карбіді:
m(дом.)=m(CаС2 з дом.)-m(CаС2)=40 г-32 г=8 г
Обчислюємо масову частку домішок в технічному кальцій карбіді:
ω(дом.)=(m(дом.):m(CаС2 з дом.))•100%=(8 г : 40 г)•100%=20%
Відповідь: 20%