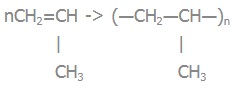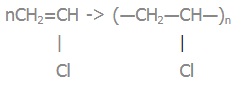![]()
Вправа 1. Поясніть суть поняття «полімер». Полімер — сполука, молекули якої складаються з великої кількості однакових груп атомів. Що входить до складу полімерів? Мономерні ланки, що багато разів повторюються
Вправа 2. Обґрунтуйте, чому полімери не мають постійної молекулярної маси. У масі полімеру є молекули різної довжини, з різними ступенями полімеризації й, відповідно, з різними відносними молекулярними масами
Вправа 3. Наведіть приклади відомих вам лінійних, розгалужених і просторових природних та синтетичних полімерів.
|
Будова макромолекул |
Лінійна |
Розгалужена |
Просторова |
|
Синтетичні полімери |
поліетилен низького тиску, каучук |
поліетилен високого тиску, поліпропілен |
вулканізований каучук, феноло-формаль- дегідні пластмаси, гума |
|
Природні полімери |
Амілоза, целюлоза, білки, нуклеїнові кислоти |
Крохмаль, глікоген, амілопектин |
вовна |
Вправа 4. Складіть рівняння реакцій полімеризації з утворенням поліетилену, поліпропілену, поліхлоровінілу.
| Полімер | Рівняння реакцій полімеризації |
| поліетилен | nCH2=CH2 -> (―CH2―CH2―)n |
| поліпропілен |
|
| поліхлоровініл |
|
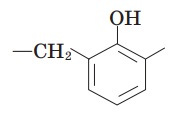
Вправа 5. Складіть формулу структурної ланки фенолоформальдегідної пластмаси.
Вправа 6. Охарактеризуйте властивості відомих вам пластмас, назвіть сфери їх застосування.
Легкі, міцні, довговічні (не зазнають корозії), термопластичні чи термореакційні, діелектрики, здатні забарвлюватися, деякі з них мають гарні оптичні властивості, стійкі до дії хімічних речовин.
Поліетилен і поліпропілен застосовують як конструкційні та ізоляційні матеріали, політетрафлуоретилен (тефлон) — для виготовлення деталей, що піддаються тертю, використовують як антипригарне покриття, поліхлоровініл — для виготовлення штучної шкіри, є ізоляційним матеріалом, фенолоформальдегідні пластмаси — для виготовлення електрообладнання (штепсельні розетки, вмикачі-вимикачі, патрони для електроламп) тощо
Вправа 7. Обчисліть, який об’єм кисню (н.у.) витратиться під час згоряння целюлози масою 16,2 кг.
Відомо: m((C6H10O5)n)=16,2 кг
Знайти: V(O2)-?
Розв'язування
Записуємо рівняння реакції:
16,2 кг x м3
(C6H10O5)n + 6nО2 = 6nCO2 + 6nH2O
162n кг 134,4n м3
M((C6H10O5)n)=162n кг/кмоль, маса 1 кмоль=182n кг
За н.у. 1 кмоль газу займає об'єм 22,4 м3, а 6n кмоль газу займуть 134,4n м3
х=V(CO2)=16,2 кг • 134,4n м3 : 162n кг = 13,44 м3
Відповідь: 13,44 м3
Вправа 8. Глюкозу, що утворилася внаслідок гідролізу крохмалю масою 6,48 кг, піддали спиртовому бродінню. Обчисліть об’єм карбон (ІV) оксиду (н.у.), що утворився, якщо втратами знехтувати.
Відомо: m((C6H10O5)n)=6,48 кг
Знайти: V(СO2)-?
Розв'язування
Записуємо рівняння реакції гідролізу крохмалю:
6,48 кг x кг
(C6H10O5)n + nН2О -> nC6H12O6
162n кг 180n кг
M((C6H10O5)n)=162n кг/кмоль, маса 1 кмоль=162n кг
M(C6H12O6)=180 кг/кмоль, маса 1 кмоль=180 кг, а маса n кмоль=180n кг
х=m(C6H12O6)=6,48 кг • 180n кг : 162n кг=7,2 кг
Записуємо рівняння реакції спиртового бродіння глюкози:
7,2 кг x м3
C6H12O6 -> 2C2H5OH + 2CO2
180 кг 44,8 м3
За н.у. 1 кмоль газу займає об'єм 22,4 м3, а 2 кмоль газу займуть 44,8 м3
х=V(CO2)=7,2 кг • 44,8 м3 : 180 кг = 1,792 м3
Відповідь: 1,792 м3 СО2