![]()
Вправа 1. Охарактеризуйте склад і будову молекули бензену. Склад молекули відображає його молекулярна формула С6Н6. Молекула має форму правильного шестикутника, плоска, зв’язки між атомами Карбону рівноцінні, їхня довжина становить 0,140 нм, тобто є однаковою. Валентний кут дорівнює 120°.
Вправа 2. Складіть молекулярну та структурну формули бензену. С6Н6
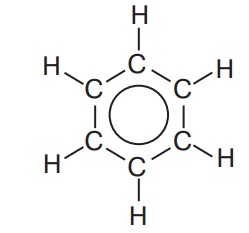
Поясніть, як утворюються хімічні зв’язки в молекулі. Кожний з атомів Карбону віддає по два електрони на утворення зв’язків між собою і один електрон — на утворення зв’язків з атомами Гідрогену. За рахунок четвертих електронів в молекулі бензену існує особливий вид хімічного зв’язку — ароматичний зв’язок. Під час його утворення одна р-орбіталь кожного атома Карбону перекривається з такими самими двома р-орбіталями (по одній від кожного сусіднього атома Карбону). Тому всі зв’язки С—С у бензені однакові й мають довжину 0,140 нм.
Вправа 3. Напишіть рівняння реакцій:
а) горіння бензену;
2С6H6 + 15O2 → 12CO2 + 6H2O
б) взаємодії з хлором за яскравого освітлення;
C6H6 + 3Cl2 → C6H6Cl6
в) взаємодії з воднем за нагрівання й наявності каталізатора.
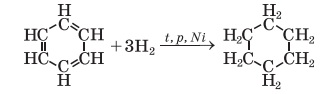
Вправа 4. Складіть рівняння реакцій за схемою:
СаС2 → С2Н2 → С6Н6 → С6Н5Cl.
CaC2 + 2H2O → Ca(OH)2 + C2H2
3C2H2 → C6H6
C6H6 + Cl2 → C6H5Cl + HCl
Вправа 5. Напишіть рівняння реакцій добування бензену:
а) з гексану;
CH3—CH2—CH2—CH2—CH2—CH3 → C6H6 + 4H2
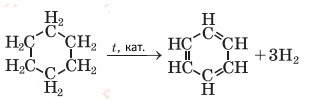
б) з циклогексану.
Вправа 6. Бензен об’ємом 200 мл (густина 0,88 г/мл) прореагував із хлором за яскравого освітлення. Обчисліть, який об’єм хлору (н. у.) витратився.
Відомо: V(C6H6)=200 мл, ρ(C6H6)=0,88 г/мл
Знайти: V(Сl2)-?
Розв'язування
m(C6H6)=V(C6H6)•ρ(C6H6)=200 мл•0,88 г/мл=176 г
Складаємо рівняння реакції:
176 г х л
C6H6 + 3Сl2 → C6H6Cl6
78 г 3•22,4 л
Mr(C6H6)=6•Ar(C)+6•Ar(H)=6•12+6•1=78, M(C6H6)=78 г/моль, маса 1 моль=78 г
х=m(Cl2)=176 г • (3•22,4 л) : 78 г = 151,6 л
Відповідь: 151,6 л
Вправа 7. Бензен масою 16,25 кг з масовою часткою речовини 96% вступив у реакцію з хлором під дією нагрівання та за наявності каталізатора. Обчисліть масу речовини, що утворилася, і назвіть її.
Відомо: m(C6H6)=16,25 кг, ω(С6Н6)=96%
Знайти: m(С6H6Cl6)-?
Розв'язування
mчистий(C6H6)=ω(С6H6)•m(C6H6):100%=96%•16,25 кг:100%=15,6 кг
Записуємо рівняння реакції:
15,6 кг х кг
C6H6 + 3Cl2 → C6H6Cl6
78 кг 291 кг
Mr(C6H6)=6•Ar(C)+6•Ar(H)=6•12+6•1=78, M(C6H6)=78 кг/кмоль, маса 1 кмоль=78 кг
Mr(C6H6Cl6)=6•Ar(C)+6•Ar(H)+6•Ar(H)=6•12+6•1+6•35,5=291,
M(C6H6Сl6)=291 кг/кмоль, маса 1 кмоль=291 кг
х=m(C6H6Cl6)=15,6 кг • 291 кг : 78 кг = 58,2 кг
Відповідь: 58,2 кг, 1,2,3,4,5,6-гексахлороциклогексан
Вправа 8. Арен масою 1,56 кг повністю спалили в атмосфері кисню. Утворився карбон (ІV) оксид масою 5,28 г. Густина пари цієї речовини за гелієм дорівнює 19,5. Обчисліть і виведіть молекулярну формулу арену.
Відомо: m(СхНу)=1,56 г, m(CO2)=5,28 г, DHe(CxHy)=19,5
Знайти: формула СхНу -?
Розв'язування
M(СО2)=Ar(C)+2•Ar(O)=12+2•16=44, маса 1 моль=44 г
У 44 г СО2 ― 12 г С, тоді
у 5,28 г СО2 ― х г С
х=m(C)=5,28 г•12 г : 44 г=1,44 г
m(H)=m(CxHy)-m(C)=1,56 г - 1,44 г=0,12 г
Знаходимо співвідношення атомів Карбону та Гідрогену в молекулі арену:
х:у=m(C)/M(C):m(H)/M(H)=1,44/12:0,12/1= 0,12:0,12=1:1,отже, найпростіша формула СН
M(CH)=Ar(C)+Ar(H)=12+1=13
M(CxHy)=DHe(CxHy)•M(He)=19,5•4=78
M(CxHy):M(CH)=78:13=6, тобто індекси біля Карбону і Гідрогену у найпростішій формулі треба збільшити у 6 разів, тому істинна формула С6Н6
Відповідь: С6Н6
Вправа 9. Із природного газу з об’ємною часткою метану 80% добули етин. Одержану речовину пропустили через активоване вугілля, нагріте до температури 600°С. Обчисліть, який об’єм природного газу потрібно мати, щоб добути бензен об’ємом 177,3 мл (густина 0,88 г/мл).
Відомо: φ(СН4)=80%, або 0,8, V(C6H6)=177,3 мл, ρ(C6H6)=0,88 г/мл
Знайти: V(суміші)-?
Розв'язування
m(C6H6)=V(C6H6)•ρ(C6H6)=177,3 мл•0,88 г/мл=156 г
Записуємо рівняння реакції добування бензену:
х л 156 г
3C2H2 → C6H6
3•22,4 л 78 г
Mr(C6H6)=6•Ar(C)+6•Ar(H)=6•12+6•1=78, M(C6H6)=78 г/моль, маса 1 моль=78 г
х=V(C2H2)=156 г • (3•22,4 л) : 78 г =134,4 л
Записуємо рівняння реакції добування етину:
х л 134,4 л
2CH4 → C2H2 + 3Н2
2●22,4 л 22,4 л
х=V(CH4)= 134,4 л • (2•22,4 л) : 22,4 л =268,8 л
V(суміші)=V(CH4):φ(СH4)=268,8 л : 0,8=336 л
Відповідь: 336 л природного газу