![]()
Вправа 13 Скільки електронів може максимально перебувати на:
а) одній атомній орбіталі; Два
б) s-підрівні; Два
в) p-підрівні; Шість
г) d-підрівні? Десять
Вправа 14 Дайте визначення принципу найменшої енергії, правила Хунда, принципу Паулі.
Принцип найменшої енергії: в атомі кожний електрон намагається зайняти орбіталь із мінімальним значенням енергії, що відповідає найміцнішому його зв’язку з ядром.
Правило Хунда: на одному енергетичному підрівні електрони розподіляються по орбіталях таким чином, щоб число неспарених електронів було максимальним.
Принцип Паулі: на одній орбіталі можуть перебувати не більш ніж два електрони, причому їхні спіни мають бути антипаралельними.
Схарактеризуйте їхнє значення для визначення розподілу електронів в електронній оболонці атома. Ці принципи є універсальними і виконуються для всіх елементів.
Вправа 15 Що називають «неспареним електроном», «електронною парою»? Один електрон, що міститься на орбіталі, називають неспареним. Два електрони з протилежними спінами, що містяться на орбіталі, називають спареними, або електронною парою
Вправа 16 Чому перший енергетичний рівень заповнюється раніше за другий? Електрони першого енергетичного рівня мають найменшу енергію, оскільки рухаються поблизу ядра атома
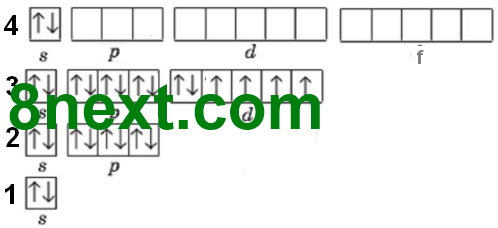
Вправа 17 Наведіть порядок заповнення електронами підрівнів для перших чотирьох енергетичних рівнів.
1s 2s 2p 3s 3p 4s 3d 4p
Примітка: 4d- та 4f-підрівні в елементів четвертого періоду не заповнюються.
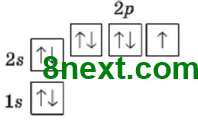
Вправа 18 Чому в атомах Берилію електрони другого енергетичного рівня перебувають на s-орбіталі, а не на р-орбіталі? На останньому (другому) енергетичному рівні в атома Берилію є два електрони які за принципом найменшої енергії, заповнюють s-орбіталь
Вправа 19 Скільки енергетичних рівнів зайнято електронами в атомах:
а) Натрію; Три
б) Кальцію; Чотири
в) Брому? Чотири
На число енергетичних рівнів електронної оболонки атома вказує номер періоду, в якій елемент перебуває
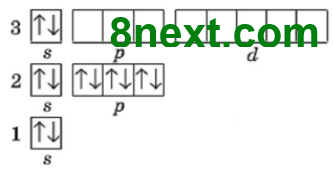
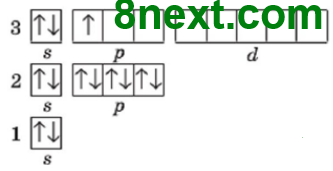
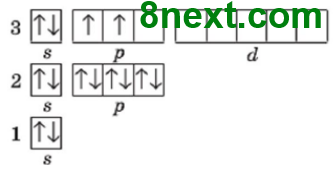
Вправа 20 Складіть графічні електронні формули атомів Нітрогену, Флуору, Магнію, Алюмінію, Силіцію та Феруму. Визначте число електронних пар та неспарених електронів на зовнішньому енергетичному рівні.
|
7N 1s22s22p3
Електронних пар: 1 Неспарених електронів: 3 |
| 9F 1s22s22p5
Електронних пар: 3 Неспарених електронів: 1 |
| 12Mg 1s22s22p63s2
Електронних пар: 1 Неспарених електронів: 0 |
|
13Al 1s22s22p63s23p1
Електронних пар: 1 Неспарених електронів: 1 |
| 14Si 1s22s22p63s23p2
Електронних пар: 1 Неспарених електронів: 2 |
| 26Fe 1s22s22p63s23p64s23d6
Електронних пар: 2 Неспарених електронів: 0 |
Вправа 21 Назвіть два хімічні елементи, в атомах яких на зовнішньому енергетичному рівні відсутні:
а) вільні орбіталі; Нітроген, Оксиген
б) місця для приєднання електронів. Гелій, Неон
Вправа 22 Атоми якого хімічного елемента другого періоду містять таке саме число неспарених електронів, як атоми:
а) Літію; Бор і Флуор
б) Нітрогену; Жодний
в) Берилію? - помилкова умова, відсутні неспарені електрони
Вправа 23 Складіть графічні електронні формули атомів, поданих нижче, і вкажіть, що спільного в будові електронних оболонок цих атомів і чим вони відрізняються?
а) Нітрогену і Фосфору;
 |
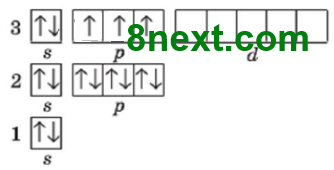 |
Cпільне: кількість електронних пар (1 і 1), неспарених електронів (3 і 3)
Відмінне: число енергетичних рівнів (2 і 3)
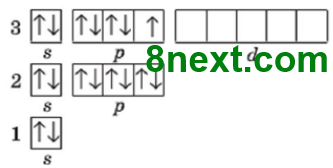
б) Оксигену і Сульфуру;
 |
 |
Cпільне: кількість електронних пар (2 і 2), неспарених електронів (2 і 2)
Відмінне: число енергетичних рівнів (2 і 3)
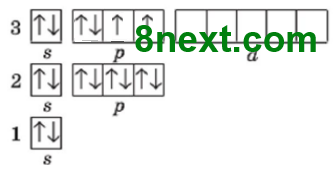
в) Флуору і Хлору.
 |
 |
Cпільне: кількість електронних пар (3 і 3), неспарених електронів (1 і 1)
Відмінне: число енергетичних рівнів (2 і 3)
Вправа 24 В атомах яких хімічних елементів заповнюється електронами:
а) 2s-підрівень; Li i Be
б) 2p-підрівень; B, C, N, O, F, Ne
в) 3s-підрівень; Na i Mg
г) 3p-підрівень; Al, Si, P, S, Cl, Ar
д) 4s-підрівень; K i Ca
е) 3d-підрівень? Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn
Вправа 25 Визначте елемент за електронною формулою зовнішнього енергетичного рівня його атомів:
а) 1s2; Гелій He
б) 2s1; Літій Li
в) 2s22p3; Нітроген N
г) 3s23p4; Сульфур S
д) 4s2; Кальцій Са
е) 3d64s2. Ферум Fe
Вправа 26 Атоми якого елемента третього періоду містять найбільше:
а) електронів; Аргон Ar
б) неспарених електронів; Фосфор Р
в) електронних пар? Аргон Ar
Вправа 27 Який енергетичний підрівень заповнюється останнім:
а) у s-елементів четвертого періоду; 4s
б) р-елементів третього періоду; 3p
в) s-елементів третього періоду; 3s
г) p-елементів другого періоду; 2p
д) d-елементів четвертого періоду? 4s