![]()
Вправа 28 Поясніть, що називають основним та збудженим станами атомів. Основним називають такий стан атома (молекули), у якому енергія атома (молекули) мінімальна. Будь-який енергетичний стан, що відрізняється від основного, називають збудженим
Вправа 29 Що відбувається з електронною оболонкою атомів під час переходу атома з основного стану в збуджений, і навпаки? Відбувається перехід електронів на інші, менш енергетично вигідні орбіталі, і, навпаки, електрони в електронній оболонці атома розподіляються згідно з принципом мінімальної енергії
Вправа 30 Дайте визначення понять «валентність» і «ступінь окиснення»?
Валентність — число хімічних зв’язків (спільних електронних пар), які певний атом може утворити з іншими атомами. Ступінь окиснення — це умовний заряд на атомі в молекулі або кристалі, який виник би на ньому, якби всі полярні зв’язки, утворені ним, мали йонний характер
У чому полягає спільність і чим вони відрізняються?
Спільність: валентність визначається числом спільних електронних пар і ступінь окиснення обчислюється з припущення про зміщення електронних пар. У багатьох сполуках абсолютна величина ступеня окиснення співпадає з їх валентністю.
Відмінність: валентність - це число ковалентних зв'язків (спільних електронних пар), якими атом з'єднаний з іншими атомами, тому поняття "валентність" застосовують для сполук молекулярної будови. Ступінь окиснення - це універсальне поняття для всіх класів сполук (молекулярної і немолекулярної будови), незалежно від виду хімічних зв'язків (ковалентний, йонний, металічний тощо), бо для зручності припускають, що всі частинки у сполуці (навіть якщо в ній зв’язки ковалентні) є йонами
Валентність визначається тільки числом ковалентних зв'язків без врахування полярності утворених зв'язків, тому немає знаку і набуває значення від I до VIII. Ступінь окиснення, на відміну від валентності, може мати позитивне (+), негативне (-) і нульове значення. Ступінь окиснення у простих речовинах дорівнює нулю, а валентність відмінна від нуля.
Вправа 31 Чому не можна застосовувати поняття «валентність» для йонних сполук? У йонних сполуках йони з різними зарядами утворюють йонний кристал, де вони чергуються в певному порядку і їх можна порахувати. Але число сусідів зовсім не співпадає з кількістю неспарених електронів, бо там взагалі немає спільних електронних пар
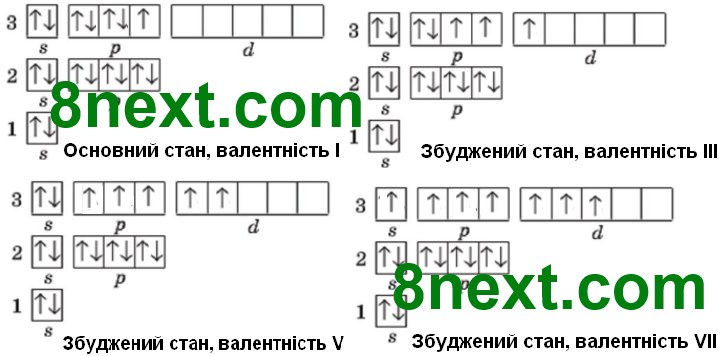
Вправа 32 Наведіть графічні електронні формули атома Хлору в основному та збуджених станах:
Вправа 33 Схарактеризуйте, які ступені окиснення є можливими для металічних та неметалічних елементів.
Вищий ступінь окиснення металічних елементів +1, +2, +3, а неметалічних + 4, +5, +6, +7, бо співпадає з номером групи, в якій елемент розміщений. Нижчий ступінь окиснення неметалічних елементів -3, -2, -1, бо дорівнює різниці між номером групи і числом 8, а для металічних елементів дорівнює 0.
Вправа 34 Електронні конфігурації атомів яких хімічних елементів є найстабільнішими? Інертних елементів
Вправа 35 Поясніть, як можна за місцем хімічних елементів у Періодичній системі визначити їх можливі валентності та ступені окиснення.
| Номер групи | I | II | III | IV | V | VI | VII |
|
Вища валентність |
I | II | III | IV | V | VI | VII |
|
Можливі валентності |
II | III | II, IV | I, III, V | |||
|
Вищий ступінь окиснення |
+1 | +2 | +3 | +4 | +5 | +6 | +7 |
|
Проміжний ступінь окиснення |
+2, 0 | +3, 0 | +4, +2, +0 | +5, +3, +1, 0 | |||
|
Нижчий ступінь окиснення |
0 | 0 | 0 | -4 | -3 | -2 | -1 |
Вправа 36 Поясніть, чому для Флуору характерний тільки негативний ступінь окиснення? Бо атом Флуору є найбільш електронегативним елементом, а електронегативність характеризує здатність атома приймати електрони
Вправа 37 Визначте валентність і ступінь окиснення всіх елементів у наведених сполуках:
а) Валентність F ― III, Br ― I. P+3Br3-1
б) Валентність C ― IV, H ― I, Br ― I. C-4H4+1Br+3
Атом водню в органічних сполуках завжди має ступінь окиснення +1, а ступінь окиснення атома Карбону вираховується, виходячи з принципу електронейтральності
в) Валентність Cl ― III, F ― I. Cl+3F3-1
г) Валентність Xe ― IV, F ― I. Xe+4F4-1
д) Валентність I ― V, F ― I. I+5F5-1
Вправа 38 За місцем елементів у Періодичній системі визначте можливі валентності й ступені окиснення:
а) Рубідію, I, +1, 0
б) Стронцію; ІІ, +2, 0
в) Фосфору; V, III, +5, +3, 0, -3
г) Брому; VII, V, III, I, +7, +5, +3, +1, 0, -1
д) Арсену. V, III, +5, +3, 0, -3
Скористайся правилами вправи 35.
Вправа 39 Визначте ступені окиснення елементів у сполуках з Гідрогеном:
C-4H4+1, N-3H3+1, H2+1S-2, H+Cl-, Ca+2H2-1
Вправа 40 Визначте ступені окиснення елементів у речовинах:
Al+3F3-1, Ba+2Cl2-1, Ca+2S-2, K3+1P-3, I20, N2+3O3-2, Pb+4Cl4-1, Cl2+7O7-2, Br+3I3-1, Na+F-, P40, Cu+2I2-1, Mg+2S-2, C+4F4-1, Ca+2O-2, C+4S2-2, Al4+3C3-4, P+5Cl5-1, Fe2+3S3-2
Вправа 41 Зобразіть структурні формули молекул: O2, OF2, H2O2. Визначте валентності та ступені окиснення Оксигену в цих молекулах.
| Формула | Структурна формула |
Валентність Оксигену |
Ступінь окиснення Оксигену |
| О2 | O=O | II | -2 |
| ОF2 | F―O―F | II | +2 |
| H2O2 | H―O―O―H | II | -1 |
Вправа 42 В атомів Хлору в збудженому стані на зовнішньому енергетичному рівні може бути 3, 5 або 7 електронів. Чому Хлор не виявляє ступені окиснення –3, –5 та –7? Ступінь окиснення негативний, якщо електрони умовно прийняті, але атом Хлору здатний прийняти тільки 1 електрон, тому виявляє негативний ступінь окиснення -1, решта позитивні +3, +5 та +7
Чи є хімічні елементи, що виявляють негативні ступені окиснення з повністю розпарованими електронними парами? Є. Це Гідроген
Атом 1Н0 1s1 Йон 1H- 1s2
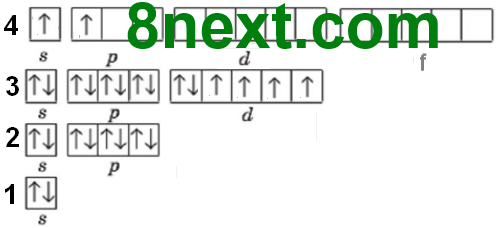
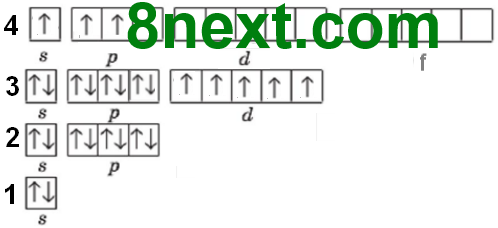
Вправа 43 Складіть електронні графічні формули атомів Феруму в збудженому стані, у якому він може виявляти ступені окиснення +2 та +3.
 |
 |
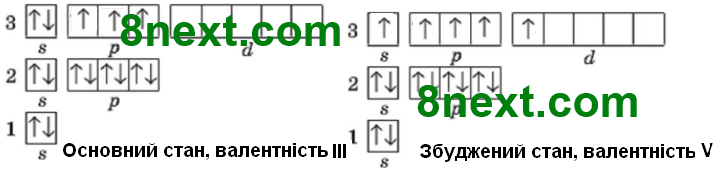
Вправа 44 Складіть електронні графічні формули зовнішнього енергетичного рівня атомів в основному та збудженому станах:
а) Силіцію

б) Фосфору
Вправа 45 Максимальна валентність та ступінь окиснення Оксигену та Флуору відрізняються від номера групи Періодичної системи, у якій вони розташовані. А для атома Нітрогену максимальний ступінь окиснення і максимальна валентність не співпадають. Чим, на вашу думку, це можна пояснити? Бо в електронній оболонці атомів цих хімічних елементів немає вільних орбіталей
Вправа 46 Як ви вважаєте, чому в Оксигену вищий ступінь окиснення -2 і він не співпадає з вищим ступенем окиснення інших елементів його підгрупи? Бо Оксиген найбільш електронегативний елемент у цій підгрупі і в електронній оболонці його атома немає вільних орбіталей
Вправа 47 Елементи VIIIА групи називають інертними через дуже низьку хімічну активність. Але за останні 60 років для більшості з них одержано сполуки, наприклад KrF2, XeF4, RnO3. Однак для Гелію та Неону жодної ковалентної сполуки ще не одержано. Як можна пояснити ці факти, ґрунтуючись на будові електронної оболонки атомів? Бо в електронній оболонці атомів Гелію і Неону всі електрони спарені і немає вільних орбіталей