![]()
Вправа 48 Чим зумовлені металічні та неметалічні властивості елементів?
Числом валентних електронів в електронній оболонці атомів. Металічні елементи мають мале число валентних електронів, а неметалічні - велике
Вправа 49 Як за Періодичною системою визначити число валентних електронів в електронних оболонках атомів хімічних елементів головних підгруп? За номером групи, в якій хімічний елемент перебуває
Вправа 50 Чому атоми приймають або віддають електрони в хімічних реакціях? Це пояснюється електронегативністю елементів
Вправа 51 Схарактеризуйте та поясніть зміни в періодах та групах:
а) сили притягання валентних електронів до ядра;
У періоді число валентних електронів поступово збільшується, радіус атома зменшується, сила притягання валентних електронів до ядра збільшується.
У групі число валентних електронів однакове, але число заповнених електронних рівнів поступово збільшується, радіус атома зростає і чим далі від ядра перебувають валентні електрони, тим важче ядру притягувати їх.
б) металічних та неметалічних властивостей;
У періоді зі збільшенням порядкового номера елемента зростає число валентних електронів, а чим більше валентних електронів, тим складніше атомам їх віддавати, тому металічні властивості елементів послаблюються, а неметалічні — посилюються.
У підгрупі зі зростанням ядра атома зростає число енергетичних рівнів, а зі збільшенням радіуса зовнішні електрони легше втрачати, тому металічні властивості посилюються, а неметалічні властивості послаблюються.
в) радіуса атомів;
У межах періодів зі збільшенням порядкового номера хімічного елемента заряд ядра поступово збільшується, що спричиняє сильніше притягання електронів до ядра, і тому радіус атомів поступово зменшується.
У головних підгрупах зі збільшенням порядкового номера елемента збільшується число енергетичних рівнів, що заповнюється електронами, тому радіус атомів хімічних елементів однієї групи збільшується.
г) електронегативності елементів;
У періоді зі зростанням заряду ядра атома число електронів на зовнішньому енергетичному рівні атомів поступово збільшується, внаслідок цього зменшується здатність віддавати електрони і збільшується здатність їх приймати, а отже, й збільшується притягання спільних електронних пар, тобто в періодах електронегативність збільшується.
У групі електронна конфігурація атомів подібна, але число заповнених електронних шарів поступово збільшується і чим далі від ядра перебуває зовнішній електронний шар, тим важче ядру притягувати спільні електронні пари, тому електронегативність зменшується.
д) окисно-відновних властивостей простих речовин;
Чим активніший метал, тим сильнішим відновником він є. Чим активніші неметалічні властивості, тим сильнішим окисником є речовина. Отже, у періодах відновні властивості послаблюються, а окисні — посилюються, а в групах відновні властивості посилюються, а окисні послаблюються.
е) кислотно-оснóвних властивостей оксидів та гідратів оксидів.
З послабленням металічних та посиленням неметалічних властивостей хімічних елементів характерно змінюються властивості їхніх оксидів та гідратів оксидів.
Вправа 52 Назвіть елемент, що має:
а) найбільшу електронегативність; Флуор
б) найменшу електронегативність; Францій
в) найбільший радіус атома; Францій
г) найменший радіус атома; Гелій
д) найсильніші металічні властивості; Францій
е) найсильніші неметалічні властивості. Флуор
Вправа 53 Поясніть, чому Натрій і Калій є електронними аналогами. Мають подібну будову зовнішнього електронного рівня. У атомах Натрію і Калію, що розташовані в першій групі Періодичної системи, на зовнішньому рівні міститься по одному s-електрону. Відмінність лише в тому, що в Натрію зовнішнім є третій енергетичний рівень, а в Калію — четвертий.
Елементи однієї підгрупи (головної чи побічної) є електронними аналогами: будова зовнішнього електронного рівня в цих елементів є подібною.
Вправа 54 Який елемент другого періоду є електронним аналогом Магнію? Берилій
Вправа 55 Які хімічні елементи є електронними аналогами:
а) Карбону; Si, Ge, Sn, Pb
б) Нітрогену? P, As, Sb, Bi
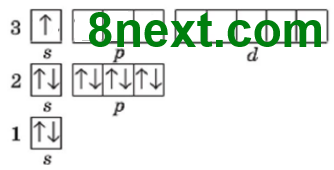
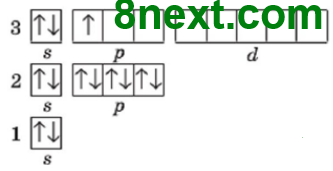
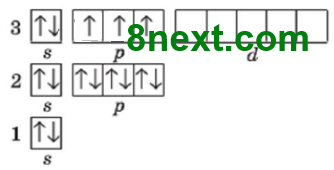
Вправа 56 Складіть графічні електронні формули атомів елементів із порядковими номерами 11, 13 та 15. Складіть формули їхніх вищих оксидів та гідратів оксидів.
|
Вищий оксид: Na2O Гідрат оксиду: NaOH |
|
Вищий оксид: Al2O3 Гідрат оксиду: Al(OH)3 |
|
Вищий оксид: P2O5 Гідрат оксиду: H3PO4 |
Порівняйте їхні:
а) металічні та неметалічні властивості;
У ряді Na-Al-P металічні властивості послаблюються, а неметалічні посилюються: Na лужний метал - Al метал - P неметал
б) електронегативності;
У ряді Na-Al-P електронегативність зростає: Na+, Al+3, P+5
в) окисно-відновні властивості простих речовин;
Na i Al - відновники, Р - окисник
г) кислотно-оснóвні властивості оксидів і гідратів оксидів.
У ряді Na-Al-P характер оксидів змінюється від oсновних через амфотерні до кислотних
У ряді Na-Al-P характер гідратів оксидів змінюється від основних (лугів) через амфотерні гідроксиди до кислот
Вправа 57 Наведіть по одному прикладу елемента третього періоду, що:
а) є активнішим металічним елементом за Літій; Натрій
б) є активнішим неметалічним елементом за Фосфор; Сульфур
в) має електронегативність більшу за Нітроген; Хлор
г) є менш активним окисником за Сульфур; Силіцій
д) є більш активним відновником за Алюміній; Натрій
е) утворює гідрат вищого оксиду із сильнішими за Силіцій кислотними властивостями. Хлор