![]()
Вправа 74 Дайте визначення ковалентному зв’язку. Хімічний зв’язок, що виникає в результаті утворення спільних електронних пар, називають ковалентним
Який ковалентний зв’язок називають полярним, а який — неполярним?
Якщо електронегативність неметалічних елементів приблизно однакова, зв’язки ковалентні неполярні, різні електронегативності — ковалентні полярні
Вправа 75 Яку електронну пару називають неподіленою? Електронну пару, яка не бере участі в утворенні хімічного зв’язку й належить самому атому, називають неподіленою
Вправа 76 Схарактеризуйте рекомбінаційний та донорно-акцепторний механізми утворення ковалентного зв’язку. Рекомбінаційний механізм утворення ковалентного зв'язку полягає в тому, що для утворення спільної електронної пари кожний з атомів надає у спільне користування по одному неспареному електрону, утворюючи певну кількість спільних електронних пар.
Донорно-акцепторний механізм утворення ковалентного зв'язку полягає в тому, що один атом — донор — надає неподілену електронну пару, а інший — акцептор — надає в користування вільну орбіталь і для обох атомів ця електронна пара стає спільною, а отже, утворюється ковалентний зв’язок.
Вправа 77 Від чого залежить полярність ковалентного зв’язку? Від різниці електронегативності елементів. Чим більшою є ця різниця, тим більш полярним є зв'язок
Вправа 78 Як визначити, на якому з атомів, сполучених ковалентним зв’язком, з’являється негативний заряд, а на якому — позитивний?
Зіставляючи значення електронегативності для різних елементів. Атом, до якого зміщена електронна пара, набуває певного негативного заряду, а атом, від якого зміщена електронна пара, — деякого позитивного заряду
Вправа 79 Поясніть, як за значеннями електронегативностей розрізнити ковалентний неполярний, ковалентний полярний та йонний зв’язки. Якщо різниця між електронегативностями елементів (∆EH) не перевищує 0,4 - зв'язок ковалентний неполярний, ∆EH менша за 2 - ковалентний полярний, ∆EH перевищує 2 - йонний
Вправа 80 У яких сполуках існують:
а) ковалентний неполярний зв’язок;
Існує у сполуках, утворених однаковими неметалічними елементами або різними неметалічними елементами, що мають приблизно однакові значення електронегативності
б) ковалентний полярний зв’язок?
Існує у сполуках, утворених неметалічними елементами з різними значеннями електронегативності
Вправа 81 Чим принципово відрізняється ковалентний зв’язок від йонного?
Ковалентний зв’язок утворюється за рахунок об'єднання валентних електронів і утворення спільних електронних пар, а йонний — повною передачею електронів від одного атома до другого з перетворенням атомів на різнойменно заряджені йони
Сформулюйте дві відмінності йонного зв’язку від ковалентного. По-перше, йонний зв'язок, на відміну від ковалентного, не можна характеризувати спрямованістю, бо в йонних кристалах кожний йон притягується до всіх протилежно заряджених йонів, розташованих у будь-яких напрямках і на будь-яких відстанях від нього; по-друге, кожний йон утворює необмежено велике число йонних зв'язків, тому йонний зв'язок є ненасиченим і поняття валентності елемента в йонній сполуці немає сенсу
Вправа 82 Зобразіть перекривання атомних орбіталей для утворення хімічного зв’язку в: молекулах гідроген хлориду, хлору, води, метану, амоніаку, йоні амонію. Складіть для них електронно-крапкові графічні формули:
| H:Cl | Cl:Cl | H:O:H |
H .. H:C:H .. H |
H:N:H .. H |
H .. [H:N:H]+ .. N |
Вправа 83 Наведіть по дві формули сполук, у яких Оксиген утворює зв’язок:
а) йонний; CaO, NaOH
б) ковалентний. O2, CO2
Вправа 84 Випишіть із поданого переліку окремо формули сполук, у яких хімічний зв’язок:
а) ковалентний неполярний; H2, O2, N2, F2, S8, P4
б) ковалентний полярний; HBr, CO2, CO, NO2, NH3, NF3, OF2, ClF3, NO
в) йонний. Na2O, CaO, K3N, MgF2
Вправа 85 Складіть формулу Льюїса для молекули сірки S2.
|
.. .. :S::S: |
Скільки електронних пар беруть участь в утворенні ковалентного зв’язку між атомами Сульфуру? Дві
Чи виконується правило октету? Виконується
Вправа 86 Схарактеризуйте спільні та відмінні риси рекомбінаційного та донорно-акцепторного механізмів утворення ковалентного зв’язку. Поясніть донорно-акцепторний механізм утворення ковалентного зв’язку на прикладі йона амонію.
У молекулі амоніаку NH3 атом Нітрогену має чотири електронні пари, з них, три р-електрони є спільними з трьома s-електронами атомів Гідрогену, а четверта пара 2s-електронів неподілена. При контакті молекули амоніаку NH3 з йоном Н+ пара 2s-електронів атома Нітрогену (донор електронної пари) переходить у порожню 1s-орбіталь йона Гідрогену (акцептор електронної пари) і стає спільною для обох частинок, утворюється ще один ковалентний зв'язок за донорно-акцепторним механізмом. Позитивний заряд тепер належить усьому йону амонію, а всі утворені атомом Нітрогену чотири зв’язки однакові й не відрізняються один від одного.
Спільні риси: утворення ковалентного зв'язку через формування спільних електронних пар
Відмінні риси: спільні електронні пари ковалентного зв'язку у обмінному механізмі з’являються за рахунок об’єднання неспарених електронів обох атомів, а у донорно-акцепторному — зміщенням неподіленої електронної пари одного атома у вільну орбіталь іншого.
Вправа 87 Запишіть формули наведених речовин за порядком збільшення полярності зв’язку в їхніх молекулах: H2O, CH4, HF, NH3.
Відповідь: СH4, NH3, H2O, HF
Вправа 88 За Періодичною системою на форзаці обчисліть різницю електронегативностей елементів у парах: Li–Cl, Be–Cl, B–Cl, C–Cl, N–Cl, O–Cl, F–Cl. Укажіть пару елементів із найбільш полярним і найменш полярним зв’язками.
| пара атомів | Li—Cl | Ве-Сl | В-Сl | С-Сl | N-Cl | О—Cl | F-Cl |
|
електронегативність |
Li—1,0 Cl—3,5 |
Ве—1,5 Сl—3,5 |
В—2,0 Сl—3,5 |
С—2,5 Сl—3,5 |
N—3,0 Cl—3,5 |
О—3,5 Cl—3,5 |
F—4,0 Cl—3,5 |
|
різниця електронегативністі |
2,5 | 2 | 1,5 | 1 | 0,5 | 0 | 0,5 |
Відповідь: з найбільш полярним зв'язком Li–Cl, а найменш полярним — O–Cl
Чим більшою є різниця електронегативністей атомів елементів, тим полярнішим є зв'язок
Вправа 89 Серед наведених речовин випишіть сполуки з найбільшою та найменшою полярністю зв’язку: HI, HCl, HBr, H2O, H2S, Cl2, CH4, PH3.
Відповідь: з найбільшою полярністю зв'язку H2O та найменшою — PH3
Чим більшою є різниця електронегативностей атомів елементів у речовині, тим більш полярним є зв'язок. Усі сполуки містять атоми Гідрогену (за винятком Cl2 - сполука з ковалентним неполярним зв'язком), тому достатньо порівняти електронегативність атомів решти елементів за шкалою Полінга:
... > O > N > Cl > Br > S > С > P >...> H
Вправа 90 Поясніть, як знання значення електронегативності елементів сполучених атомів дозволяє зробити висновок щодо типу хімічного зв’язку між ними.
Якщо різниця між значеннями електронегативностей елементів (∆EH) не перевищує 0,4 - зв'язок ковалентний неполярний, ∆EH менша за 2 - ковалентний полярний, ∆EH перевищує 2 - йонний
Вправа 91 За Періодичною системою виберіть елементи з невеликою різницею електронегативностей. Складіть для них формули бінарних сполук із ковалентним неполярним зв’язком.
Відповідь: PH3, CH4, SiH4
Вправа 92 Зобразіть структурні формули магній сульфату та калій карбонату. Позначте на них типи хімічних зв’язків.
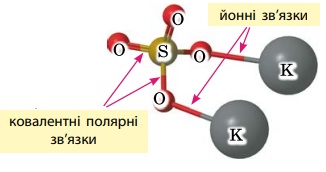 |
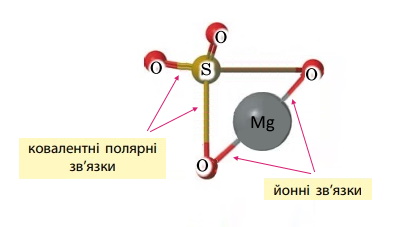 |
Вправа 93 Обчисліть відносну густину гідроген хлориду й амоніаку за повітрям та поясніть, чому в демонстраційному досліді на с. 31 тампон, просочений амоніаком, поміщають у нижній отвір трубки, а тампон із хлоридною кислотою — у верхній.
Dповітря(HCl)=M(Cl):M(повітря)=36,5 г/моль:29 г/моль=1,25
Dповітря(NH3)=M(NH3):M(повітря)=17 г/моль:29 г/моль=0,58
Бо метан легший за повітря і піднімається вгору, а гідроген хлорид важчий за повітря і опускається вниз і приблизно посередині скляної трубки спостерігаємо появу туману — продукту взаємодії амоніаку з гідроген хлоридом — кристалічного амоній хлориду .
Чи зміняться спостереження в цьому досліді, якщо тампони поміняти місцями? Зміняться
Вправа 94 У деяких посібниках стверджують, що способи утворення ковалентного зв’язку можна описати двома формулами: 1+1=2 та 2+0=2. Доведіть або спростуйте це твердження. Мова йде про два способи утворення ковалентного зв’язку: рекомбінаційний (обмінний) та донорно-акцепторний
Вправа 95 Відомо, що в природі всі процеси відбуваються задля підвищення стабільності. Не може бути вигідним, щоб в одному місці було чогось дуже багато, а в іншому — дуже мало. З огляду на це, як можна пояснити енергетичну вигідність утворення зв’язку за донорно-акцепторним механізмом? Адже за рекомбінаційним механізмом зв’язок утворюють частинки з нестабільною електронною оболонкою, а в атома Нітрогену в молекулі амоніаку та в йона Гідрогену електронні оболонки цілком стабільні. Утворюється ще один хімічний зв'язок (ковалентний), що зумовлює стійкість йона амонію.
Вправа 96 Поняття «валентність» некоректно застосовувати для елементів у складі йонних сполук. Як ви вважаєте, які принципові відмінності речовин із ковалентним та йонним зв’язками зумовлюють цю некоректність? Значення валентності хімічного елемента визначається кількістю спільних електронних пар, які утворює його атом з іншими атомами в молекулі. Електронні пари утворюються тільки у випадку ковалентного зв'язку, тому валентність можна визначити тільки в сполуках з ковалентним зв'язком.
Вправа 97 Чому межі різниці електронегативностей між різними типами зв’язку, наведеними на малюнку 6.4, є умовними? Вони обрані з огляду на ступінь зміщення спільної електронної пари: за різниці електронегативностей ∆ЕН<0,4 спільна електронна пара зміщується не більш ніж на 5%, а за різниці ∆ЕН>2 — більш ніж на 70%.