![]()
Вправа 98 Дайте визначення водневому зв’язку. Водневий зв’язок — це взаємодія атома Гідрогену однієї молекули (або її частини), сполученого з дуже електронегативним атомом, із неподіленою електронною парою дуже електронегативного атома іншої молекули (або її частини)
Завдяки чому він утворюється? Молекула певної речовини утворює водневий зв’язок за наявності неподілених електронних пар на одному з атомів та за наявності дуже полярного зв’язку з одним із атомів Гідрогену. Водневий зв’язок має частково електростатичний характер, а частково — донорно-акцепторний
Вправа 99 Як впливає наявність водневого зв’язку у воді та спиртах на їхні фізичні властивості? Спирти добре розчиняються у воді, мають вищу температуру кипіння у порівнянні з іншими молекулярними сполуками і близькими значеннями молярної маси, але без водневих зв’язків.
Вправа 100 Схарактеризуйте, як можливість утворення водневого зв’язку впливає на:
а) розчинність речовин у воді;
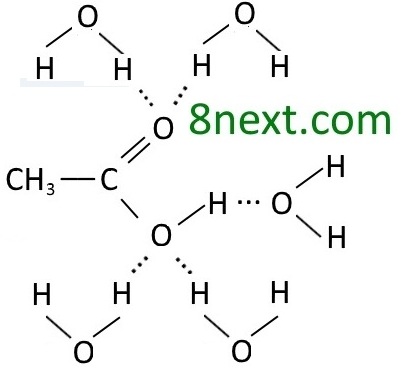
Речовини, що можуть утворювати водневі зв'язки з молекулами води, краще розчиняються в ній завдяки більш тісній взаємодії
б) теплоємність води;
Висока теплоємність води пояснюється тим, що під час випаровування водневі зв'язки рвуться і їх міцність зменшується з підвищенням температури
в) поверхневий натяг води?
Високий поверхневий натяг води зумовлений тим, що водневі зв'язки заважають молекулам води рухатися з різною швидкістю, бо у рідкій воді молекули води розташовані невпорядковано та близько одна до одної
Вправа 101 Назвіть основні властивості водневого зв’язку:
— є міжмолекулярним і значно посилює притягання молекул;
— зумовлює підвищення температури кипіння;
— зумовлює підвищення розчинності речовин у воді
Вправа 102 Порівняйте фізичні властивості речовин, зазначених на малюнку 7.3 (с. 39). Який факт свідчить про наявність водневого зв’язку між молекулами води? Значно вища температура кипіння води у порівнянні з гідроген сульфідом - молекулярної речовини з близьким значенням молярної маси
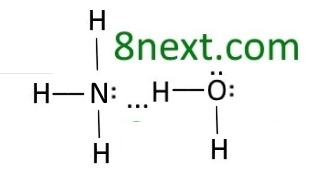
Вправа 103 Зобразіть утворення водневого зв’язку між молекулами:
а) води та амоніаку;
|
|
б) етанолу та води
 |
в) етанової кислоти та води
 |
Вправа 104 Використовуючи знання про фізичні властивості органічних речовин, проілюструйте вплив на них водневого зв’язку на прикладі:
а) етану й етанолу
Температура кипіння етанолу за нормального тиску (+78,3°С) значно вища, ніж етану (–89°С) — вуглеводню, від якого походить етанол
б) етанолу й гліцеролу
Гліцерол кипить, розкладаючись, при +290 °С, тобто за вищої температури, ніж етанол, бо водневих зв’язків у гліцеролі утворюється значно більше, адже його молекула містить три гідроксильні групи, а молекула етанолу — лише одну.
в) етанолу й етаналю
Температура кипіння етаналю нижча, ніж етанолу, що пояснюється відсутністю водневих зв’язків між молекулами етаналю
Вправа 106 Проаналізуйте діаграми та схарактеризуйте вплив водневих зв’язків на фізичні властивості речовин. Поясніть, що спільного й відмінного між речовинами на кожній діаграмі. На кожній діаграмі спостерігаємо вплив водневих зв'язків на істотну різницю температури кипіння цих речовин у порівнянні з іншими речовинами однакової молекулярної будови чи з близькими значенням молярної маси, але без водневих зв’язків.
Діаграма 1. Температура кипіння фтороводню HF, між молекулами якої існує водневий зв'язок, значно вища (tкип.=190С) у порівнянні з решти сполуками подібної молекулярної будови: HCl (tкип.=-85,1°С), HBr (tкип.=-66,4°С), HI (tкип.=-35,4°С).
Діаграма 2. Температура кипіння води Н2О, молекули якої найлегші, але між ними існує водневий зв'язок, є найвища (tкип.=100°С) у порівнянні з решти сполуками подібної молекулярної будови: H2S (tкип.=–60,8°С), H2Se (tкип.=–41,3°С), H2Te (tкип.=–2,2°С).
Діаграма 3. Температура кипіння етанової кислоти, етанолу, між молекулами яких існує водневий зв'язок, значно вищі (tкип.=181,1°С і tкип.=78,4°С відповідно) у порівнянні з решти органічними сполуками: етан (tкип.–88,6 °С), метилетаноат (tкип.=57,1 °С)
Діаграма 4. Температура кипіння метанолу, між молекулами яких існує водневий зв'язок, значно вища (tкип.=64,7°С) у порівнянні з вуглеводнями: метан (tкип.=–161,6°С), етан (tкип.=–88,6°С), пентан (tкип.=36°С)
Нагадаємо: водневий зв’язок утворюється атомами Гідрогену переважно з атомами Оксигену, Флуору та Нітрогену. Температура кипіння є значно вищою, оскільки на руйнування додаткової взаємодії, с саме наявного водневого зв'язку, потрібна додаткова енергія.