![]()
Вправа 211 Схарактеризуйте місце елементів-галогенів у Періодичній системі та їхні загальні властивості. Хімічні елементи-галогени розташовані в VIIA групі Періодичної системи. Це Флуор F, Хлор Cl, Бром Вr, Йод I і Астат At. Слово "галогени" означає "ті, що породжують солі". Усі галогени реагують з металами, утворюючи солі.
Вправа 212 Чому для Флуору можливі лише два ступеня окиснення? У Флуору найбільша електронегативність, тому для нього можливі лише два ступені окиснення: 0 (у F2) і –1 (в решти сполуках).
Вправа 213 Який із галогенів є найсильнішим окисником? Фтор
Вправа 214 Схарактеризуйте фізичні й хімічні властивості та застосування хлору. За звичайних умов — зеленувато-жовтий газ, має характерний різкий задушливий запах, що нагадує запах «хлорки», приблизно у 2,5 рази важчий за повітря, негорючий, отруйний, розчин у воді — хлорна вода.
Вправа 216 Порівняйте хімічну активність хлору з активністю інших галогенів. За хімічною активністю хлор поступається тільки фтору.
Вправа 217 Для рівняння реакції хлору з воднем складіть електронний баланс, укажіть окисник і відновник.
Cl2 + H2 = 2HCl
Сl20 + H20 → H+1Cl-1
Відновник H20 - 2e- -> 2H+1 2│2│1
Окисник Cl20 + 2e- -> 2Cl-1 2│ │1
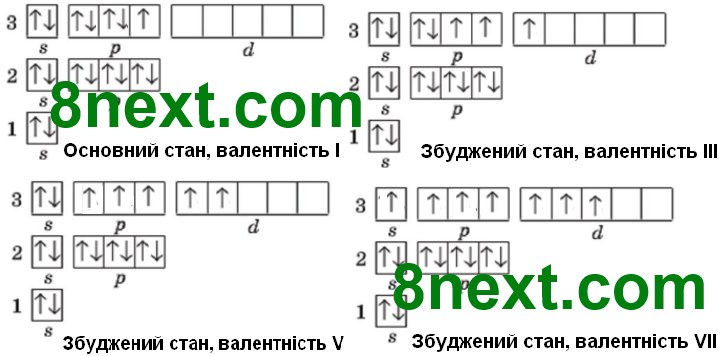
Вправа 218 Зобразіть розподіл електронів на зовнішньому енергетичному рівні атомів Хлору в основному та збудженому станах. Схарактеризуйте можливі валентні стани Хлору.
Вправа 219 Визначте ступені окиснення Хлору в сполуках:
Cl20, HСl-1, NaCl-1, AlСl3-1, PСl5-1, Cl+3F3, Cl2+1O, KСl+5O3, HСl+3O2, Mg(Cl+7O4)2
Вправа 220 Складіть електронний баланс для реакцій. Укажіть окисник і відновник:
а) KСlO3 + HСl → KCl + Cl2 + H2O;
KСl+5O3 + HСl-1 → KCl-1 + Cl20 + H2O;
Відновник 2Cl-1 - 2e- -> Сl20 2│6│3
Окисник Cl+5 + 6e- -> Cl-1 6│ │1
KСlO3 + 6HСl = KCl + 3Cl2 + 3H2O;
б) PbO2 + HCl → PbСl2 + Cl2 + H2O;
Pb+4O2 + HCl-1 → Pb+2Сl2 + Cl20 + H2O;
Відновник 2Cl-1 - 2e- -> Сl20 2│2│1
Окисник Pb+4 + 2e- -> Pb+2 2│ │1
PbO2 + 4HCl → PbСl2 + Cl2 + 2H2O;
в) KMnO4 + HCl → MnСl2 + Cl2 + KCl + H2O.
KMn+7O4 + HCl-1 → Mn+2Сl2 + Cl20 + KCl + H2O
Відновник 2Cl-1 - 2e- -> Сl20 2│10│5
Окисник Mn+7 + 5e- -> Mn+2 5│ │2
2KMnO4 + 16HCl → 2MnСl2 + 5Cl2 + 2KCl + 8H2O
Вправа 221 Силіцій реагує з хлором, утворюючи вищий хлорид. Складіть рівняння реакції, електронний баланс для неї, укажіть окисник і відновник.
Si + 2Cl2 = SiCl4
Si0 + Cl20 → Si+4Cl4-1
Відновник Si0 - 4e- -> Si+4 4│4│1
Окисник Cl20 + 2e- -> 2Cl-1 2│ │2
Вправа 222 Етин в атмосфері горить кіптявим полум’ям. Складіть рівняння цієї реакції.
Реакція горіння — це реакція взаємодії з киснем, а кіптяву полум'ю надають чаточки сажі (С). Беручи до уваги те, що етин на повітрі горить кіптявим полум'ям, записуємо реакцію горіння етину:
2C2H2 + 5O2 → 4CO2 + 2H2О
Вправа 223 У скільки разів хлор важчий за повітря? У 2,45 разів
Mr(Cl2)=71, Mr(повітря)=29
Mr(Cl2):Mr(повітря)=71:29=2,45 рази
Обчисліть густину хлору за нормальних умов.
ρ(Сl2)=M(Cl2):Vм=71 г/моль:22,4 л/моль=3,17 г/л
Вправа 224 Густина хлору за температури 20°С становить 2,96 г/л. За цих умов в одному об’ємі води максимально розчиняється три об’єми хлору. Обчисліть масову частку хлору в насиченому розчині.
Відомо: V(H2O)=1 л, V(Cl2)=3 л, ρ(Сl2)=2,96 г/л
Знайти: w(Cl2)-?
Розв'язування
m(Cl2)=V(Cl2)•ρ(Cl2)=3 л•2,96 г/л=8,88 г
m(H2O)=V(H2O)•ρ(H2O)=1 л•1 г/л=1 г
m(розчину)=m(Cl2)+m(H2O)=8,88 г + 1 г = 9,88 г
w(Cl2)=m(Cl2):m(розчину)=8,88 г : 9,88 г = 0,89, або 89%
Відповідь: 89%
Вправа 225 Хлор добре розчиняється в органічних розчинниках, наприклад у тетрахлорометані: у 100 мл розчинника за температури 20°С розчиняється 5480 мл хлору. Обчисліть масову частку хлору в цьому розчині, якщо відомо, що густина тетрахлорометану дорівнює 1,63 г/мл, а хлору — 2,96 г/л.
Відомо: V(тетрахлорометану)=100 мл, V(Cl2)=5480 мл,
ρ(тетрахлорометану)=1,63 мл/л, ρ(Сl2)=2,96 г/л
Знайти: w(Cl2)-?
Розв'язування
m(тетрахлорометану)=V(тетрахлорометану)•ρ(тетрахлорометану)=100 мл•1,63 г/мл=163 г
m(Cl2)=V(Cl2)•ρ(Cl2)=5480 мл • 0,00296 г/мл=16,2208 г
m(розчину)=m(Cl2)+m(тетрахлорметану2O)=16,2208 г + 163 г = 179,2208 г
w(Cl2)=m(Cl2):m(розчину)=16,2208 г : 179,2208 г = 0,0905, або 9,05%
Відповідь: 9,05%
Вправа 226 Який об’єм хлору необхідний для реакції з воднем об’ємом 25 л? Який об’єм хлороводню утвориться?
Відомо: V(H2)=25 л
Знайти: V(Cl2)-?, V(HCl)-?
Розв'язування
Записуємо рівняння реакції:
H2 + Cl2 = 2HCl
За рівнянням реакції V(H2):V(Cl2):V(HCl)=1:1:2, тому
V(Cl2)=V(H2)=25 л
V(HCl)=2•V(H2)=2•25 л=50 л
Відповідь: 25 л хлору, 50 л хлороводню
Вправа 227 Під час взаємодії фосфору з хлором одержали фосфор (III) хлорид масою 13,75 г. Обчисліть об’єм витраченого хлору (н.у.), якщо відносний вихід продукту реакції становить 75%.
Відомо: mпракт.(PCl3)=13,75 г, η(PCl3)=75%, або 0,75
Знайти: V(Cl2)-?,
Розв'язування
mтеорет.(PCl3)=mпракт.(PCl3):η(PCl3)=13,75 г:0,75=18,33 г
M(PCl3)=137,5 г/моль
n(PCl3)=mтеорет.(PCl3):M(PCl3)=18,33 г:137,5 г/моль=0,133 моль
Записуємо рівняння реакції:
2P + 3Cl2 = 2PCl3
За рівнянням реакції n(Cl2):n(PCl3)=3:2, тому
n(Cl2)=3•n(PCl3):2=3•0,133 моль:2=0,2 модь
V(Cl2)=n(Cl2)•VM=0,2 моль•22,4 л/моль=4,48 л
Відповідь: 4,48 л хлору
Вправа 229 Обчисліть об’єм хлору (н.у.), що утвориться під час взаємодії хлоридної кислоти з манган (IV) оксидом масою 17,4 г, якщо відносний вихід продукту реакції становить 80%. Взаємодія відбувається за схемою:
HCl + MnO2 → MnCl2 + Cl2 + H2O.
Відомо: mпракт.(MnO2)=17,4 г, η(MnO2)=80%, або 0,8
Знайти: V(Cl2)-?,
Розв'язування
mтеорет.(MnO2)=mпракт.(MnO2):η(MnO2)=17,4 г:0,8=21,75 г
M(MnO2)=87 г/моль
n(MnO2)=mтеорет.(MnO2):M(MnO2)=21,75 г : 87 г/моль=0,25 моль
Записуємо рівняння реакції: 4HCl + MnO2=MnCl2+Cl2+2H2O
За рівнянням реакції n(MnO2):n(Cl2)=1:1, тому
n(Cl2)=n(MnO2)=0,25 модь
V(Cl2)=n(Cl2)•VM=0,25 моль•22,4 л/моль=5,6 л
Відповідь: 5,6 л хлору
Вправа 230 Хлоровмісні суміші часто застосовують для вибілювання бавовни, паперу та інших матеріалів вуглеводної природи. Але вони непридатні для відбілювання вовни й шовку. Запропонуйте пояснення цього факту. Вовна й шовк - матеріали білкового походження, а під дією цих чинників руйнується структура білків
Вправа 231 Карл Шеєлє, який відкрив хлор 1774 року, писав про нього так: «Комахи в ньому негайно гинуть», «Синій лакмусовий папір стає майже білим, усі червоні, сині квіти й навіть зелені рослини жовтіють», «Ані луги, ані кислоти вже не відновлюють первісного забарвлення квітів і листя». Які властивості хлору описав Шеєлє? Хлор - отруйний газ. Його розчин у воді - хлорна вода є сильним відбілювачем.