![]()
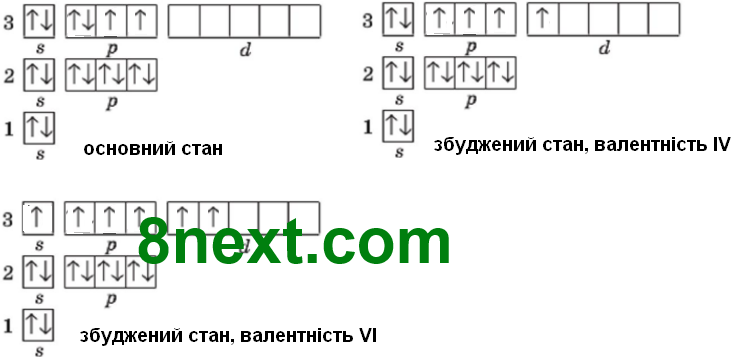
Вправа 281 Схарактеризуйте валентні стани Сульфуру.
Вправа 282 Порівняйте фізичні властивості різних алотропних модифікацій Сульфуру.
Ромбічна сірка - світло-жовтий порошок або яскраво-жовті кристали з молекулярними кристалічними ґратками; крихка; нерозчинна у воді, але розчиняється в органічних розчинниках (етанол, хлороформ, бензен тощо);густина 2,07 г/см3; tпл.=112,8°С, tкип.=444,5°С; стабільна за температури менше 95,4°С
Моноклінна сірка - темно-жовті голки з молекулярними кристалічними ґратками; крихка; нерозчинна у воді, розчиняється в неполярних органічних розчинниках (гексан, хлороформ, бензен тощо); густина 1,96 г/см3; tпл.=119,3°С, tкип.=444,5°С; стабільна за температури вище 95,4°С, за меншої температури перетворюється на ромбічну сірку
Пластична сірка - темно-коричнева або темно-жовта аморфна речовина; еластична, гумоподібна, нерозчинна, густина 1,92 г/см3; плавиться в діапазоні температур, tкип.=445°С; нестабільна, протягом кількох годин стає крихкою і перетворюється на ромбічну
Вправа 283 З якими речовинами сірка виявляє властивості окисника, а з якими — відновника? Сірка є окисником у реакціях з воднем, металами, деякими неметалами (які походять від найменш електронегативних неметалічних елементів), а відновником — у реакціях з галогенами, киснем, оксидами металічних елементів
Вправа 284 Схарактеризуйте застосування сірки. Сірку застосовують у виробництві сульфатної кислоти, у процесі вулканізації для перетворення каучуку на різні види гуми, а також для одержання органічних барвників, лікарських препаратів, є складовою пороху й інших піротехнічних сумішей
Вправа 285 Схарактеризуйте поширеність та біологічне значення Сульфуру.
Найбільші родовища сірки в Україні зосереджені переважно у Львівській та Івано-Франківській областях.
Сульфур - важливий для існування життя елемент, міститься у складі амінокислот (цистеїн та метіонін). Саме завдяки Сульфуру залишки цих амінокислот у молекулах білків беруть участь в утворенні дисульфідних містків, що стабілізують третинну структуру білка. Він є у складі деяких вітамінів (біотин, тіамін) і ферментів
Вправа 286 Взаємодія сірки з цинком відбувається так само, як і з алюмінієм. Складіть рівняння реакції та електронний баланс для цієї реакції.
S + Zn = ZnS
S0 + Zn0 → Zn+2S-2
Відновник Zn0 - 2e- -> Zn+2 2│2│1
Окисник S0 + 2e- -> S-2 2│ │1
Вправа 287 Складіть рівняння реакцій утворення фосфор (III) сульфіду, натрій сульфіду, ферум (III) сульфіду з простих речовин. Укажіть окисник і відновник.
2P + 3S = P2S3
P0 + S0 → P2+3S3-2
Відновник P0 - 3e- -> P+3 3│6│2
Окисник S0 + 2e- -> S-2 2│ │3
Na + S = Na2S
2Na0 + S0 → Na2+1S-2
Відновник Na0 - 1e- -> Na+1 1│2│2
Окисник S0 + 2e- -> S-2 2│ │1
2Fe + 3S = Fe2S3
Fe0 + S0 → Fe2+3S3-2
Відновник Fe0 - 3e- -> Fe+3 3│6│2
Окисник S0 + 2e- -> S-2 2│ │3
Вправа 288 У якій природній речовині масові частки Сульфуру й Оксигену однакові? У SO2
Відомо: w(S)=w(O)
Знайти: SxOy-?
Розв'язування
w(S)=x•Ar(S)/M(SxOy) i w(О)=у•Ar(О)/M(SxOy), прирівняємо ліві частини рівностей, матимемо
x•Ar(S)=у•Ar(О), тому
32•x=16•у
Вираз має зміст при х=1 і у=2, тому формула сполуки SO2
Відповідь: SO2
Вправа 289 Визначте, у якій зі сполук — PbS, MnS, FeS, NiS, BaSO4 — масова частка Сульфуру найбільша, а в якій — найменша.
Відповідь: найбільша в MnS, а найменша в PbS
Чи можна відповісти на це запитання без обчислень? Можна
Достатньо порівняти відносні атомні маси елементів, відмінних від Сульфуру, що входять у сполуки:
Ar(Mn)<Ar(Fe)<Ar(Ni)<Ar(Ba)+4Ar(O)<Ar(Pb)
Вправа 290 Скільки атомів Сульфуру міститься:
а) у 2 моль цинкової обманки ZnS;
У 1 моль ZnS міститься 1 моль атомів Сульфуру, а в 2 моль цієї сполуки кількість речовини атомів у 2 рази більша: 1•2 моль=2 моль
n(S)=n(ZnS)=2 моль
N(S)=n(S)•NA=2 моль•6,02•1023 моль-1=12,04•1023
б) у 0,1 моль мірабіліту Na2SO4•10H2O?
Молекула Na2SO4•10H2O складається з 1 атому Сульфуру, тому в 1 моль мірабіліту Na2SO4•10H2O міститься 1 моль атомів Сульфуру, а в 0,1 моль цієї сполуки кількість речовини атомів у 0,1 рази більша: 1•0,1 моль=0,1 моль
n(S)=n(Na2SO4•10H2O)=0,1 моль
N(S)=n(S)•NA=0,1 моль•6,02•1023 моль-1=0,602•1023
Вправа 291 Обчисліть об’єм сульфур (IV) оксиду (н.у.), що утворюється під час спалювання сірки масою 80 г.
Відомо: m(S)=80 г
Знайти: V(SO2)-?
Розв'язання
n(S)=m(S):M(S)=80 г : 32 г/моль=2,5 моль
Запишемо рівняння реакції:
S + O2 = SO2
За рівнянням реакції n(S):n(SO2)=1:1, тому
n(SO2)=n(S)=2,5 моль
V(SO2)=n(SO2)•VM=2,5 моль•22,4 л/моль=56 л
Відповідь: 56 л SO2
Вправа 292 Змішали сірку й залізо масою по 56 г та прожарили. Обчисліть масу утвореної солі.
Відомо: m(S)=m(Fe)=56 г
Знайти: m(FeS)-?
Розв'язання
M(S)=32 г/моль, M(Fe)=56 г/моль, M(FeS)=88 г/моль
n(S)=m(S):M(S)=56 г:32 г/моль=1,75 моль
n(Fe)=m(Fe):M(Fe)=56 г:56 г/моль=1 моль
Запишемо рівняння реакції:
S + Fe = FeS
За рівнянням реакції n(S)/1=n(Fe)/1. Підставимо значення у рівність,
отримуємо нерівність 1,75/1>1 отже, сірка взята в надлишку, вона реагує не повністю, тому розрахунки будемо проводити за даними Fe.
За рівнянням реакції n(Fe):n(FeS)=1:1, тому
n(FeS)=n(Fe)=1 моль
m(FeS)=n(FeS)•M(FeS)=1 моль•88 г/моль=88 г
Відповідь: 88 г
Вправа 293 Як ви вважаєте, чому ромбічна та моноклінна сірки мають різні густини, різні температури плавлення, але однакову температуру кипіння? Бо у випарах сірка існує у вигляді однієї сполуки, що складається з двохатомних молекул S2
Вправа 294 Як можна схарактеризувати кристалічні ґратки пластичної сірки? Ґратки характеризуються закономірним розміщенням навколо кожної частинки її ближніх сусідів, хоч аморфні тверді тіла здатні зберігати форму, кристалічної решітки у них немає