![]()
Вправа 338 Порівняйте фізичні властивості амоніаку й азоту.
Амоніак — безбарвний газ із характерним різким запахом, отруйний, дуже добре розчиняється у воді, tкип.=–33°С, tпл.=–78°С, густина за нормальних умов 0,76 г/л, легко скраплюється, у рідкому стані — безбарвна рухома рідина
Азот — газ без кольору, смаку, запаху, малорозчинний у воді, tкип.=–196°С, tпл.=–210°С, густина за нормальних умов 1,251 г/л, рідкий та твердий азот — безбарвні
Вправа 339 Зобразіть будову молекули амоніаку та йона амонію.
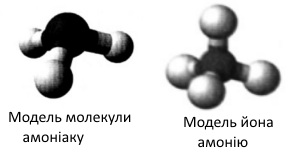
Вправа 340 Складіть формули нітрату, хлориду, сульфату, карбонату й ортофосфату амонію.
NH4NO3, NH4Cl, (NH4)2SO4, (NH4)2CO3, (NH4)3PO4
Вправа 341 Як одержують амоніак у лабораторних умовах і в промисловості?
У лабораторії амоніак добувають, нагріваючи суміш солі амонію з надлишком лугу або кальцій гідроксиду:
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O слабке нагрівання
У промисловості — синтезом амоніаку, яку здійснюють за температури 450-5000С, тиску 200-300 атм. і наявності каталізатора:
N2 + 3H2 ⇄ 2NH3 (над ⇄ вкажіть t, p, кат.)
Вправа 342 Складіть рівняння реакцій:
а) натрій гідроксиду з амоній сульфатом;
2NaOH + (NH4)2SO4 = Na2SO4 + 2NH3↑ + 2H2O
б) кальцій гідроксиду з амоній нітратом.
Ca(OH)2 + 2NH4NO3 = Ca(NO3)2 + 2NH3↑ + 2H2O
Вправа 343 Доберіть коефіцієнти в схемах реакцій. Які властивості амоніаку характеризують ці рівняння? Назвіть солі, що утворюються. Для окисно-відновних реакцій складіть електронний баланс.
а) 2NH3 + H3PO4 = (NH4)2HPО4 Реагує з кислотами як основа
Амоній гідрогенфосфат
б) NH3 + H2S = (NH4)HS Реагує з кислотами як основа
Амоній гідрогенсульфід
в) 8NH3 + 3Br2 = 6NH4Br + N2 Амоніак є відновником
N-3H3 + Br20 → NH4Br-1 + N20
Відновник 2N-3 - 6e- -> N20 6│6│1
Окисник Br20 + 2e- -> 2Br-1 2│ │3
г) 2NH3 + 3CuO → 3Cu + N2 + 3H2O Амоніак є відновником
N-3H3 + Cu+2O → Cu0 + N20 + H2O
Відновник 2N-3 - 6e- -> N20 6│6│1
Окисник Cu+2 + 2e- -> Cu0 2│ │3
Вправа 344 Запропонуйте, як можна одержати купрум (ІІ) оксид із купрум (ІІ) сульфату у дві стадії, використовуючи лише водний розчин амоніаку.
NH4OH + CuSO4 = Cu(OH)2↓ + (NH4)2SO4
Cu(OH)2↓=CuO + H2O
Вправа 345 Взаємодією амоніаку з вуглекислим газом одержують сечовину (NH2)2CO, що використовується як азотне добриво. Запишіть рівняння реакції.
2NH3 + CO2 = (NH2)2CO + H2O
Вправа 346 Магній нітрид Mg3N2 піддається необоротному гідролізу. Що відбудеться, якщо замість води під час досліду використати хлоридну кислоту? Складіть ці рівняння реакцій.
Mg3N2 + 6H2O = 3Mg(OH)2↓ + 2NH3↑
Mg3N2 + 8HCl = 3MgCl2 + 2NH4Cl
Вправа 347 Який об’єм амоніаку теоретично можна одержати з водню об’ємом 6 л та азоту об’ємом 3 л?
Відомо: V(H2)=6 л, V(N2)=3 л
Знайти: V(NH3)-?
Розв'язання
n(H2)=V(H2):VM=6 л : 22,4 л/моль=0,26 моль
n(N2)=V(N2):VM=3 л : 22,4 л/моль=0,13 моль
Запишемо рівняння реакції:
3H2 + N2 = 2NH3↑
За рівнянням реакції n(H2)/3=n(N2)/1. Підставимо значення у рівність,
отримуємо нерівність 0,26/3<0,13/1 моль, отже, азот взято в надлишку, він реагує не повністю, тому розрахунки будемо проводити за даними Н2.
За рівнянням реакції n(H2):n(NH3)=3:2, тому
n(NH3)=2•n(H2):3=2•0,26 моль:3=0,17 моль
V(NH3)=n(NH3)•VM=0,17 моль•22,4 л/моль=3 л
Відповідь: 3 л NH3
Вправа 348 Обчисліть об’єм нітроген (ІІ) оксиду, який можна одержати шляхом каталітичного окиснення амоніаку об’ємом 100 л. Який об’єм кисню при цьому витратиться?
Відомо: V(NH3)=100 л
Знайти: V(NO)-?, N(O2)-?
Розв'язання
n(NH3)=V(NH3):VM=100 л : 22,4 л/моль=4,46 моль
Запишемо рівняння реакції:
4NH3 + 5O2 = 4NO + 6H2O
За рівнянням реакції n(NH3):n(O2):n(NO)=4:5:4, тому
n(NO)=4•n(NH3):4=4•4,46 моль:4=4,46 моль
n(O2)=5•n(NH3):4=5•4,46 моль:4=5,575 моль
V(NO)=n(NO)•VM=4,46 моль•22,4 л/моль=100 л
V(O2)=n(O2)•VM=5,575 моль•22,4 л/моль=124,88 л
Відповідь: 100 л NO i 124,88 л O2
Вправа 349 Який об’єм амоніаку (н.у.) потрібний для приготування його розчину масою 50 г із масовою часткою амоніаку 25%?
Відомо: m(р-ну)=50 г, w(NH3)=25%
Знайти: V(NH3)-?
Розв'язання
m(NH3)=(m(р-ну)•w(HN3)):100%=50 г•25%:100%=12,5 г
M(NH3)=17 г/моль
n(NH3)=m(NH3):M(NH3)=12,5 г : 17 г/моль=0,735 моль
V(NH3)=n(NH3)•VM=0,735 моль • 22,4 л/моль=16,5 л
Відповідь: 16,5 л амоніаку
Вправа 350 Обчисліть об’єм амоніаку (н.у.), що утвориться під час нагрівання кальцій гідроксиду масою 9,2 г з амоній хлоридом масою 10,7 г.
Відомо: m(Сa(OH)2)=9,2 г, m(NH4Cl)=10,7 г
Знайти: V(NH3)-?
Розв'язання
M(Ca(OH)2)=74 г/моль, M(NH4Cl)=53,5 г/моль
n(Ca(OH)2)=m(Ca(OH)2):M(Ca(OH)2)=9,2 г : 74 г/моль=0,124 моль
n(NH4Cl)=m(NH4Cl):M(NH4Cl)=10,7 г : 53,2 г/моль=0,2 моль
Запишемо рівняння реакції:
Ca(OH)2 + 2NH4Cl = CaCl2 + 2NH3 + 2H2O
За рівнянням реакції n(Ca(OH)2)/1=n(NH4Cl)/2. Підставимо значення у рівність,
отримуємо нерівність 0,124/1>0,2/2, отже, кальцій гідроксид взято в надлишку, він реагує не повністю, тому розрахунки проводимо за даними NH4Cl.
За рівнянням реакції n(NH4Cl):n(NH3)=2:2=1:1, тому
n(NH3)=n(NH4Cl)=0,2 моль
V(NH3)=n(NH3)•VM=0,2 моль•22,4 л/моль=4,48 л
Відповідь: 4,48 л амоніаку