![]()
Вправа 1 Поясніть, чому в рівняннях оборотних хімічних реакцій замість знака "=" використовують знак "⇄". Знак "⇄" вказує на одночасний перебіг двох протилежних за напрямками реакцій ― прямої (⟶) та оберненої (<-)
Вправа 2
а) Чому до необоротних процесів відносять горіння деревини, зсідання молока, скисання виноградного соку, а до оборотних - електролітичну дисоціацію гідроген сульфіду у водному розчині, утворення гідроген йодиду, перетворення кисню на озон, газування води карбон (ІV) оксидом? Перші три процеси відносять до необоротних, на відміну від наступних трьох, тому що утворені продукти не взаємодіють між собою і процеси відбуваються доти, поки повністю не витратиться один із реагентів
Складіть рівняння оборотних реакцій.
H2S ⇄ 2H+ + S2-
H2 + I2 ⇄ 2HI
3O2 ⇄ 2O3
H2O + CO2 ⇄ H2СO3
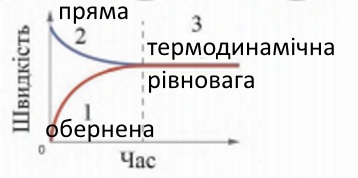
б) Нітроген (ІV) оксид (газ бурого кольору) унаслідок охолодження перетворюється на безбарвний димер. Цей процес оборотний: зміщення хімічної рівноваги визначають за зміною інтенсивності забарвлення газу ― з підвищенням температури вона посилюється. На рисунку 9.5 зображено графіки швидкостей прямої та оберненої реакцій. Визначте, який з графіків відображає зміну швидкості прямої реакції, який ― оберненої, а який фрагмент графіків відповідає стану динамічної рівноваги. Фрагмент 2 ― зміна швидкості прямої реакції, фрагмент 1 ― оберненої, а фрагмент 3 ― стан динамічної рівноваги
Вправа 3 Перетворіть схеми наведених оборотних реакцій на хімічні рівняння. Проаналізуйте зміщення хімічної рівноваги в цих реакціях для збільшення виходу продуктів реакції під упливом різних чинників:
а) СО(г) + Н2O(г) ⇄ СO2(г) + Н2(г), ∆H<0
Збільшити концентрацію одного з реагентів, знизити температуру (пряма реакція екзотермічна, що протікає з виділенням енергії і послаблюється зовнішнім впливом ― охолодженням).
б) 2СО(г) + О2(г) ⇄ 2СО2(г), ∆H<0
Збільшити концентрацію одного з реагентів, знизити температуру (пряма реакція екзотермічна, що протікає з виділенням енергії і послаблюється зовнішнім впливом ― охолодженням), підвищити тиск (в прямій реакції число молекул газоподібних речовин зменшується (з 3 до 2), тобто знижується тиск у системі, отже, підвищення тиску зміщуватиме рівновагу у бік зменшення числа молекул газів).
в) N2O4(г) ⇄ 2NO2 (г), ∆H>0
Підвищити температуру (пряма реакція ендотермічна, що протікає з поглинанням енергії і послаблюється зовнішнім впливом ― нагріванням), знизити тиск (в прямій реакції число молекул газоподібних речовин збільшується (з 1 до 2), тобто підвищується тиск у системі, отже, зниження тиску зміщуватиме рівновагу у бік збільшення числа молекул газів).
г) С(т) + Н2О(г) ⇄ СО(г) + Н2(г), ∆H>0
Збільшити концентрацію одного з реагентів, підвищити температуру (пряма реакція ендотермічна, що протікає з поглинанням енергії і послаблюється зовнішнім впливом ― нагріванням), знизити тиск (в прямій реакції число молекул газоподібних речовин збільшується (з 1 до 2), тобто підвищується тиск у системі, отже, зниження тиску зміщуватиме рівновагу у бік збільшення числа молекул газів). .
д) РСl5(г) ⇄ РСl3(г) + Сl2(г); ∆H > 0
Підвищити температуру (пряма реакція ендотермічна, що протікає з поглинанням енергії і послаблюється зовнішнім впливом ― нагріванням), знизити тиск (в прямій реакції число молекул газоподібних речовин збільшується (з 1 до 2), тобто підвищується тиск у системі, отже, зниження тиску зміщуватиме рівновагу у бік збільшення числа молекул газів).
Вправа 4 У виробництві сульфатної кислоти використовують оборотну реакцію окиснення сульфур (ІV) оксиду до сульфур (VІ) оксиду киснем (реакція екзотермічна, реагенти й продукти ― гази). Складіть термохімічне рівняння цієї реакції.
2SO2(г) + O2(г) ⇄ 2SO3(г), ∆H<0