![]()
Вправа 47 Серед наведених формул укажіть ті, що відповідають речовинам із ковалентним зв’язком: MgI2, CH4, SO2, SiCl4, Na2S.
Відповідь: CH4, SO2, SiCl4
Вправа 48 Охарактеризуйте хімічний зв’язок у молекулі хлороводню.
На зовнішньому енергетичному рівні в атомі Гідрогену міститься один s-електрон, а в атомі Хлору — два s-електрони і п'ять р-електронів, з яких один неспарений р-електрон. Унаслідок взаємодії s-електрона атома Гідрогену та неспареного р-електрона атома Хлору утворюється одна спільна електронна пара, яка зміщена до більш електронегативного елемента Хлору
Зобразіть перекривання відповідних орбіталей атомів, укажіть кратність зв’язку.
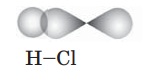
Атоми в молекулах хлороводню сполучені простим ковалентним зв’язком
Полярним чи неполярним є зв’язок між атомами Гідрогену і Хлору? Відповідь обґрунтуйте. Спільна електронна пара зміщена до більш електронегативного елемента Хлору, бо сили притягання з боку Хлору значно більші, оскільки більшим є заряд ядра атома Хлору (+17) у порівнянні з зарядом ядра атома Гідрогену (+1). Зв'язок у молекулі хлороводню ковалентний полярний.
Вправа 49 У формулах речовин Cl2O і NH3 із ковалентними полярними зв’язками підкресліть атом більш електронегативного елемента й зазначте заряди на атомах, використавши літеру δ.
Відповідь: Cl2δ+Oδ- і Nδ-Н3δ+
Вправа 50 Складіть графічну формулу молекули гідроген пероксиду Н2О2.
Н—O—О—H
Який зв’язок у цій молекулі є неполярним?Між двома атомами Оксигену O—О
Які значення валентності та ступеня окиснення має кожний елемент у сполуці? Валентність Гідрогену І та ступінь окиснення +1, валентність Оксигену ІІ та ступінь окиснення -1
Вправа 51 Порівняйте обмінний і донорно-акцепторний механізми утворення ковалентного зв’язку.
За обмінним механізмом спільні електронні пари ковалентного зв'язку з’являються за рахунок об’єднання неспарених електронів обох атомів, а за донорно-акцепторним механізмом — за рахунок зміщення неподіленої електронної пари одного атома у вільну орбіталь іншого.
Поясніть назви обох механізмів. Обмінний, бо атоми ніби обмінюються електронами. Донорно-акцепторний, бо донор — атом, який надає власну (вільну) електронну пару, а акцептор — атом, який приймає на власну вільну орбіталь. Латиною dono означає «дарую», a accipio означає «приймаю», «отримую»
Вправа 52 Молекула BF3 сполучається з йоном F– завдяки утворенню ковалентного зв’язку за донорно-акцепторним механізмом. Запишіть формулу йона продукту цієї взаємодії.
|
F | [F—B—F]+ | F |
Яка частинка є донором електронної пари, а яка — її акцептором? Йон Флуору є донором електронної пари, а атом Бору — її акцептором
Яку орбіталь надає акцептор для розміщення електронної пари донора? Зважте на те, що атом Бору перебуває в молекулах і складних йонах у збудженому стані. р-орбіталь
Вправа 53 Які речовини серед наведених у переліку є молекулярними: пропан, негашене вапно, метанол, сірководень, срібло? Пропан, метанол, сірководень
Які ознаки вказують на це? Молекулярні речовини утворені атомами неметалічних елементів, вид хімічного зв'язку між атомами ковалентний.
Вправа 54 Чому карбон (IV) оксид і силіцій (IV) оксид мають різні фізичні властивості, хоча в них реалізується один тип хімічного зв’язку — ковалентний? Бо карбон (IV) оксид має молекулярну будову, а силіцій (IV) оксид — атомну.
Вправа 55 Бор — проста речовина елемента з такою самою назвою — плавиться за температури 2075°С, вирізняється високою твердістю. Молекулярну чи атомну будову має бор? Атомну