![]()
Вправа 193 Запишіть формули мінералів Fe3Al2(SiO4)3 і Ca3Fe2(SiO4)3 (їх загальна назва — гранати) за допомогою формул відповідних оксидів.
Fe3+2Al2(SiO4)3 — 3FeO•Al2O3•3SiO2
Ca3Fe2+3(SiO4)3 — 3CaO•Fe2O3•3SiO2
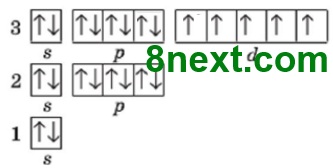
Вправа 194 Складіть електронні формули катіонів Феруму та зобразіть їх графічні варіанти.
Fe2+ 1s22s22p63s23p63d6
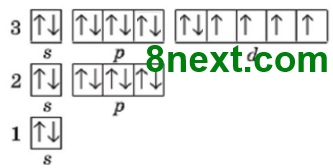
Fe3+ 1s22s22p63s23p63d5
Вправа 195 Допишіть схеми реакцій і складіть хімічні рівняння:
a) 2Fe + 3F2 = 2FeF3
FeO + H2SO4 = FeSO4 + H2O
Fe(OH)2 + 2HCl = FeCl2 + 2H2O
FeCl2 + Na2CO3 = FeСO3↓ + 2NaCl
б) Fe + AgNO3 = Fe(NO3)2 + Ag↓
Fe3O4 + H2 = 3FeO + H2O
Fe(OH)3 + H3PO4 = FePO4 + 3H2O
Fe(NO3)3 + NaOH = Fe(OH)3↓ + NaNO3
в) Fe + 2FeCl3 = 3FeCl2
Fe2O3 + CaO = Ca(FeO2)2
Fe(OH)2↓ = FeO + H2O
FeS + 2HBr = FeBr2 + H2S↑
Вправа 196 Вставте замість крапок формули речовин і перетворіть схеми реакцій на хімічні рівняння:
а) 3FeO + O2 = 2Fe3O4
Fe2(SO4)3 + 3BaCl2 = 2FeCl3 + 3BaSO4↓
Fe(OH)3 + 3HNO3 = Fe(NO3)3 + 3H2O
б) 4FeO + O2 = 2Fe2O3
Fe2O3 + Li2O = 2LiFeO2
FeCl3 + 3NH4OH = Fe(OH)3 + 3NH4Cl
Вправа 197 Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
а) Fe → FeCl2 → FeCl3 → Fe(OH)3 → Fe2(SO4)3 → FePO4;
Fe + Cl2 = FeCl2
2FeCl2 + Cl2 = 2FeCl3
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
Fe2(SO4)3 + 2H3PO4 = 2FePO4↓ + 3H2SO4
б) Fe2O3 → Ba(FeO2)2 → Fe2(SO4)3 → Fe(NO3)3 → Fe(OH)3 → Fe2O3.
Fe2O3 + BaO = Ba(FeO2)2
Ba(FeO2)2 + 4H2SO4 = BaSO4↓ + Fe2(SO4)3 + 4H2O
Fe2(SO4)3 + 3Ba(NO3)2 = 2Fe(NO3)3 + 3BaSO4↓
Fe(NO3)3 + KOH = Fe(OH)3↓ + KNO3
2Fe(OH)3↓ = Fe2O3 + 3H2O
Вправа 198 Ферум (ІІ, ІІІ) оксид реагує з кислотами подібно до суміші простих оксидів Феруму. Складіть рівняння реакцій сполуки Fe3O4 з хлоридною і розбавленою сульфатною кислотами.
Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O
Fe3O4 + 4H2SO4 (розб.) = FeSO4 + Fe2(SO4)3 + 4H2O
Вправа 199 Напишіть рівняння гідролізу нітратів Феруму в молекулярній та йонно-молекулярній формах. Зважте на те, що осади не утворюються.
1) Fe(NO3)2 ⇄ Fe2+ + 2NO3-
Сіль Fe(NO3)2 утворена слабкою основою Fe(OH)2↓ і сильною кислотою HNO3, тому гідроліз відбувається за катіоном.
1 cтадія: Fe2+ + H―OH ⇄ FeOH+ + H+
Fe2+ + 2NO3- + H―OH ⇄ FeOH+ + 2NO3- + H+
Fe(NO3)2 + H2O ⇄ Fe(OH)NO3 + HNO3 Сіль розчинна
2) Fe(NO3)3 ⇄ Fe3+ + 3NO3-
Сіль Fe(NO3)2 утворена слабкою основою Fe(OH)3↓ і сильною кислотою HNO3, тому гідроліз відбувається за катіоном.
1 стадія: Fe3+ + H―OH ⇄ FeOH2+ + H+
Fe3+ + H―OH ⇄ FeOH+ + H+
Fe3+ + 3NO3- + H―OH ⇄ FeOH+ + 3NO3- + H+
Fe(NO3)3 + H2O ⇄ Fe(OH)(NO3)2 + HNO3 Сіль розчинна
Вправа 200 Під час пропускання сірководню у водний розчин ферум (ІІІ) хлориду утворюється світло-жовтий осад простої речовини. Складіть рівняння реакції.
2FeCl3 + H2S = 2FeCl2 + S↓ + HCl
Колір сірки S світло-жовтий
Вправа 201 Виведіть формулу оксиду Феруму, в якому масова частка металічного елемента становить 70%.
Відомо: w(Fe)=70%
Знайти: формулу FexOy-?
Розв'язування
w(O)=100%-w(Fe)=100%-70%=30%
У 100 г такої речовини маса атомів Феруму становить 70 г, атомів Оксигену — 30 г. Розраховуємо співвідношення індексів у формулі вуглеводню (співвідношення кількостей речовини елементів):
х : у=n(Fe):n(O)=m(Fe)/M(Fe):m(O)/M(O)=70/56 : 30/16=
=1,25:1,875
Якщо співвідношення між атомами виражене не цілими, а дробовими числами, то вважаємо, що менше число дорівнює одиниці, а більше число ділимо на нього. Тоді
х : у=1,25/1,25:1,875/1,25=1,0:1,5
Для того щоб у співвідношенні були найменші цілі числа, помножимо обидва числа на 2:
x : y=(1,0•2):(1,5•2)=2:3, отже, формула оксиду Fe2O3
Відповідь: Fe2O3
Вправа 202 Яку масу ферум (ІІІ) нітрату потрібно взяти для добування 8 г ферум (ІІІ) оксиду?
Відомо: m(Fe2O3)=8 г
Знайти: m(Fe(NO3)3)-?
Розв'язування
І спосіб
M(Fe2O3)=160 г/моль
v(Fe2O3)=m(Fe2O3):M(Fe2O3)=8 г : 160 г/моль=0,05 моль
Записуємо рівняння реакції: 4Fe(NO3)3=2Fe2O3 + 12NO2 + 3O2↑
За рівнянням реакції v(Fe(NO3)3):v(Fe2O3)=4:2=2:1, тому
v(Fe(NO3)3)=2•v(Fe2O3)=2•0,05 моль=0,1 моль
M(Fe(NO3)3)=242 г/моль
m(Fe(NO3)3)=v(Fe(NO3)3)•M(Fe(NO3)3)=0,1 моль•242 г/моль=24,2 г
II спосіб
Записуємо рівняння реакції:
x г 8 г
4Fe(NO3)3=2Fe2O3 + 12NO2 + 3O2↑
968 г 320 г
M(Fe(NO3)3)=247 г/моль, маса 1 моль=242 г, а маса 4 моль=968 г
M(Fe2O3)=160 г/моль, маса 1 моль=160 г, а маса 2 моль=320 г
х=m(Fe(NO3)3)=8 г • 968 г : 320 г=24,2 г
Відповідь: 24,2 г
Вправа 203 Визначте кількість молекул води у формулі солі FeCl2•nH2O, якщо масова частка води у сполуці становить 36,2%.
Відомо: FeCl2•nH2O, w(H2O)=36,2% або 0,362
Знайти: n-?
Розв'язування:
M(FeCl2)=127 г/моль, M(H2O)=18 г/моль
Масова частка води в кристалогідраті обчислюється за формулою
w(H2O)=n•M(H2O)/(M(FeCl2)+n•M(H2O)
Підставимо значення у формулу, отримаємо рівняння, яке розв'язуємо.
0,362=18n/(127+18n), звідси
0,362•(127+18n)=18n
45,974+6,516n=18n
18n-6,516n=45,974
11,484n=45,974
n=4, формула кристалогідрату FeCl2•4H2O
Відповідь: n=4
Вправа 204 Який об’єм водню виділиться за нормальних умов, якщо до 1,12 г заліза додати 18 г хлоридної кислоти з масовою часткою HCl 10%?
Відомо: m(Fe)=1,12 г, m(розчину)=18 г, w(HCl)=10%, або 0,1
Знайти: V(H2)-?
Розв'язування
1. m(HCl)=w(HCl)•m(розчину)=0,1•18 г=1,8 г
2. M(HCl)=36,5 г/моль, M(Fe)=56 г/моль
n(HCl)=m(HCl):M(HCl)=1,8 г:36,5 г/моль=0,049 моль
n(Fe)=m(Fe):M(Fe)=1,12 г:56 г/моль=0,02 моль
3. Запишемо рівняння реакції: Fe + 2HCl = FeCl2 + H2↑
За рівнянням реакції 1 моль заліза реагує з 2 моль кислоти, тому з 0,02 моль заліза прореагує удвічі більша кількість кислоти, тобто 0,04 моль. За умовою задачі є 0,049 моль, отже, кислоту взято в надлишку, вона реагує не повністю, тому розрахунки будемо проводити за даними Fe.
За рівнянням реакції n(Fe):n(H2)=1:1, тому
n(H2)=n(Fe)=0,02 моль
4. V(H2)=n(H2)•VM=0,02 моль•22,4 л/моль=0,448 л
Відповідь: 0,448 л
Вправа 205 У розчин купрум (ІІ) сульфату занурили залізну пластинку масою 28 г. Через деякий час маса пластинки збільшилась до 30 г. Обчисліть масу міді, яка виділилась на пластинці. Зважте на те, що утворюваний метал із пластинки не осипається.
Відомо: маса залізної пластинки після реакції збільшилася за рахунок осідання на ній міді m(Cu) і переходу в розчин заліза m(Fe), тобто маємо:
28 г+m(Сu)-m(Fe)=30 г, звідси
m(Cu)-m(Fe)=30 г-28 г=2 г
Знайти: m(Сu)-?
Розв'язування
І спосіб
Запишемо рівняння реакції:
Fe + CuSO4 = FeSO4 + Cu↓
За хімічним рівнянням в реакцію вступає 1 моль Fe і утворюється 1 моль Cu, тому обчислюємо молярні маси речовин й, відповідно, маси 1 моль.
M(Fe)=56 г/моль, тому маса 1 моль m(Fe)=56 г
M(Cu)=64 г/моль, тому маса 1 моль m(Cu)=64 г
За рівнянням реакції різниця мас m(Cu)-m(Fe)=64 г-56 г=8 г виникає, коли осідає 64 г міді.
Для визначення маси міді складаємо пропорцію і розв'язуємо її:
різниця мас 8 г виникає при осіданні на пластинці 64 г Cu, а
різниця мас 2 г — х г Cu
х=m(Cu)=64 г • 2 г : 8 г=16 г
ІІ спосіб
1. Запишемо рівняння реакції:
Fe + CuSO4 = FeSO4 + Cu↓
2. Обчислимо кількість речовини заліза і міді, що беруть участь в реакції, склавши алгебраїчне рівняння.
За хімічним рівнянням в реакцію вступає 1 моль Fe і утворюється 1 моль Cu, тому
n(Fe)=m(Cu)=х моль
Маса заліза, яка переходить в розчин:
m(Fe)=n(Fe)•M(Fe)=х моль • 56 г/моль=56х г
Маса міді, що осідає на пластинці:
m(Cu)=n(Cu)•M(Cu)=х моль • 64 г/моль=64х г
Маса пластинки після реакції:
64х-56х=2
8х=2
х=2:8
х=0,25, тобто n(Fe)=n(Cu)=0,25 моль
3. Знаходимо масу міді кількістю речовини 0,25 моль:
m(Cu)=n(Cu)•M(Cu)=0,25 моль•64 г/моль=16 г
Відповідь: 16 г