![]()
Знаємо, розуміємо
Вправа 1 Як за допомогою періодичної системи дізнатися про:
а) кількість електронів в атомі; Дорівнює порядковому номеру елемента
б) кількість енергетичних рівнів в електронній оболонці атома? Дорівнює номеру періода, в якому розташований цей елемент
Вправа 2 Скільки максимально електронів може перебувати на підрівнях: s-, p-, d-, f-? 2, 6, 10, 14
Вправа 3 Скільки максимально електронів може перебувати на 1-му, 2-му, 3-му, 4-му енергетичних рівнях? 2, 8, 18, 32
Якщо номер енергетичного рівня позначити літерою n, то максимальну кількість електронів N на цьому рівні обчислюють за формулою N=2n2
Вправа 4 У чому полягає суть принципу «мінімальної енергії»? У атомі кожний електрон намагається зайняти орбіталь із мінімальним значенням енергії, що відповідає найміцнішому його зв’язку з ядром.
Вправа 5 Скільки енергетичних комірок на: s-, p-, d-, f-підрівнях? 1, 3, 5, 7
Застосовуємо
Вправа 1 Складіть електронну й графічну електронну формули атомів хімічних елементів з порядковими номерами 4 і 13.
|
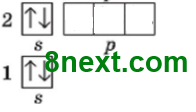
4Be 1s22s2
|
|
13Al 1s22s22p33s23p1
|
У якого з атомів усі електрони спарені? У Берилію
Вправа 2 Установіть відповідність між електронною будовою зовнішнього енергетичного рівня атома й хімічним елементом.
|
Частина електронної формули |
Хімічний елемент |
|
1 …3s23р5 2 …2s22р4 3 …3s2 4 …3s23р6 |
А Оксиген Б Неон В Хлор Г Магній Д Аргон |
Відповідь: 1-В, 2-А, 3-Г, 4-Д
Вправа 3 Укажіть можливі підрівні третього енергетичного рівня.
А s, р
Б s, p, d
В s, p, d, f
Г s, f, p
Відповідь: Б
Вправа 4 Укажіть пару s-елементів.
А Na і Al
Б Ba і Rb
В Fe і Cs
Г Ra і Cu
Відповідь: Б
Вправа 5 Укажіть електронну формулу атома елемента II групи 3-го періоду.
А 1s22s2
Б 1s22s22p1
В 1s22s22p63s2
Г 1s22s22p63s23p3
Відповідь: В
Вправа 6 Укажіть електронну формулу атома хімічного елемента із завершеним зовнішнім енергетичним рівнем.
А 1s22s22p63s2
Б 1s22s22p63s23p63d104s2
В 1s22s22p63s23p5
Г 1s22s22p6
Відповідь: Г
Вправа 7 Складіть електронні й графічні електронні формули атомів хімічних елементів з протонними числами, у кожній парі зазначте спільні і відмінні риси:
а) 7 і 15
|
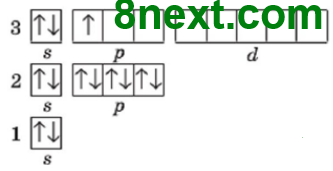
7N 1s22s22p3
|
15P 1s22s22p33s23p3
|
Cпільні риси: однакова кількість електронів на зовнішньому енергетичному рівні (шість), неспарених електронів (три)
Відмінні риси: різна кількість енергетичних рівнів (два і три)
б) 13 і 16
|
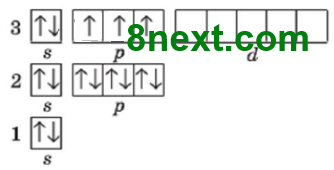
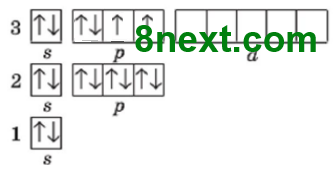
13Al 1s22s22p33s23p1
|
16S 1s22s22p63s23p4
|
Cпільні риси: однакова кількість енергетичних рівнів (три)
Відмінні риси: різна кількість електронів на зовнішньому енергетичному рівні (три і шість), кількість неспарених електронів (один і два)
Вправа 8 Складіть електронні формули атома та йона:
а) Натрію: 11Na 1s22s22p33s1 i 11Na+ 1s22s22p6
б) Хлору: 17Cl 1s22s22p33s23p5 i 17Cl7- 1s22s22p63s23p6
Вправа 9* Атом хімічного елемента має однакову кількість електронів із катіоном Калію. Визначте назву цього хімічного елемента, складіть електронну й графічну електронну формули його атома.
Запишемо електронну формулу йона Калію 19К+ 1s22s22p63s23p6
З електронної формули бачимо, що йон K+ містить 18 електронів (2+2+6+2+6=18), тому невідомим елементом з порядковим №18 є Аргон:
|
18Ar 1s22s22p33s23p6 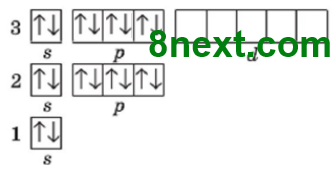 |