![]()
Знаємо, розуміємо
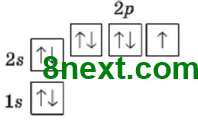
Вправа 1 Завдяки чому атоми одного хімічного елемента можуть мати різні валентні стани? Завдяки перебуванню атома у збудженому стані
Вправа 2 Поясніть, що називають ступенем окиснення. Ступінь окиснення — це умовний заряд атома в сполуці, обчислений на основі припущення, що вона складається з йонів. Ступінь окиснення може набувати позитивного, негативного та нульового значень
Вправа 3 Про що свідчить той факт, що Ферум утворює сполуки зі ступенями окиснення +2, +3 і навіть може мати ступінь окиснення +6? Про здатність електронів переходити на інші енергетичні підрівні
Застосовуємо
Вправа 1 Серед наведених електронних формул атомів укажіть, яка належить атому, що перебуває у збудженому стані.
а) 14Sі 1s22s22p63s13p3;
б) 14Sі 1s22s22p63s23p2.
Відповідь: А
Вправа 2 Складіть хімічні рівняння взаємодії, визначивши ступені окиснення елементів у них:
а) силіцію з киснем;
Si + O2 = S+4O2-2
б) силіцію з воднем;
Si + 2H2 = Si-4H4+
в) цинку з хлором;
Zn + 2Cl = Zn+2Cl2-
г) фосфору з хлором.
P + Cl = P+3Cl3-
Вправа 3 Який з хімічних елементів — Флуор чи Фосфор — має лише один валентний стан? Флуор
Поясніть чому. У електронній оболонці атома Флуору відсутні вільні орбіталі
Вправа 4 Укажіть рядок, у якому записані електронні формули одного й того самого атома в основному і збудженому станах.
А 1s22s22p63s23p4 і 1s22s22p63s23p5
Б 1s22s22p1 і 1s22s22p2
В 1s22s22p5 і 1s22s22p6
Г 1s22s22p2 і 1s22s12p3
Відповідь: Г
Зверніть увагу, що загальна кількість валентних електронів у хімічному елементі має бути однакова 2+2=1+3
Попрацюйте парами
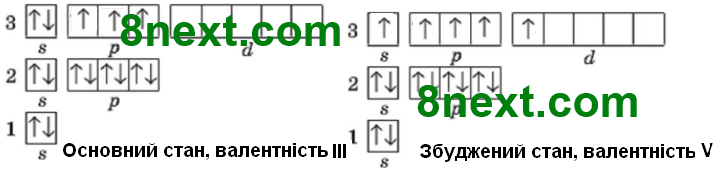
Завдання 1 З'ясуйте можливі валентні стани Флуору та Фосфору.
|
1) Флуору:
9F +9 ))
27 1s22s22p5 [Не] 2s22p5
|
2) Фосфору: 15P +15 ))) 285 1s22s22p63s23p3 [Nе] 2s22p3
|
Завдання 2 Напишіть формули сполук: