![]()
Знаємо, розуміємо
Вправа 1 Схарактеризуйте хімічну активність алюмінію. Алюміній — активний метал, що легко вступає у взаємодію з простими і складними речовинами, проявляючи відновні властивості. У ряді активності металів алюміній розташований відразу за лужними, лужноземельними металами та магнієм, що теж вказує на його високу хімічну активність.
Вправа 2 Чим ви поясните, що Алюміній має ступінь окиснення +3, а не, приміром, +2 чи –5? Алюміній - металічний елемент, атом якого має на зовнішньому енергетичному рівні 3 електрони, які легко віддає для його завершення, тому має ступінь окиснення +3
Вправа 3 Зважаючи на хімічні властивості алюмінію, сформулюйте поради щодо використання алюмінієвого кухонного посуду. Не пошкоджувати поверхню алюмінієвого кухонного посуду, щоб не зняти захисну алюмінієву оксидну плівку, яка надійно захищає метал від подальшої хімічної взаємодії
Вправа 4 Де в промисловості застосовують відновні властивості алюмінію? Для добування деяких металів, так звана алюмотермія — відновлення металів (Fe, Cr, V, Mn, Ti, W) з їх оксидів за допомогою алюмінію
Застосовуємо
Вправа 1 Схарактеризуйте хімічний елемент Алюміній та фізичні властивості утвореної ним простої речовини.
ХАРАКТЕРИСТИКА хімічного елемента АЛЮМІНІЯ
1. Протонне число Алюмінія 13, Ar=27. Елемент розміщений у третьому періоді, третьому ряді, ІІI групі, головній підгрупі. Значення валентності ІІІ
2. Ядро атома містить 13 протонів і має заряд +13, містить 14 нейтронів (27–13=14). У складі електронної оболонки 13 електронів, їх сумарний заряд –13, розміщені вони на трьох енергетичних рівнях. Електронна формула атома — 1s22s22р63s2p1.
Графічна електронна формула:
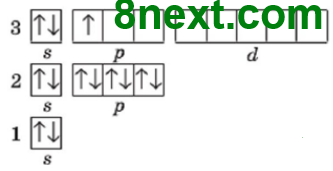
На зовнішньому енергетичному рівні міститься 2 спарених s-електрони і 1 неспарений р-електрон. Зовнішній енергетичний рівень незавершений. У сполуках проявляє ступінь окиснення +3.
3. Маючи на зовнішньому енергетичному рівні 3 електрони, Алюміній належить до металічних елементів. У вільному стані існує у вигляді простої речовини — металу алюмінію. Формула вищого оксиду — Al2O3. Хімічний характер оксиду Al2O3 й гідроксиду Al(OH)3 — амфотерний. Леткої сполуки з Гідрогеном не утворює.
4. Сусідами по періоду в Алюмінію є Магній і Силіцій, по підгрупі — Бор та Галій. Металічні властивості в Алюмінію виражені слабше, ніж у Магнію, але сильніше, ніж у Силіцію.
ФІЗИЧНІ властивості АЛЮМІНІЮ:
Алюміній — сріблясто-білий метал з виразним металевим блиском, легкий, м’який, ковкий, його густина 2,7 г/см3 і температура плавлення 660°С
Вправа 2 Чому не можна тримати луги в алюмінієвій тарі? Алюміній легко розчиняється у водних розчинах лугів з утворенням комплексної солі й водню
Вправа 3 Користуючись рядом активності металів, розташуйте метали мідь, натрій, алюміній за зростанням хімічної активності.
Відповідь: мідь, алюміній, натрій
Вправа 4 Напишіть хімічні рівняння за схемою перетворень:
4Al + 3C = Al4C3
2Al + 6HCl = 2AlCl3 + 3H2↑
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
Al(OH)3↓ = Al2O3 + H2O Реакція термічного розкладу
2Al2O3 електроліз> 4Al + 3O2
Al + N = AlN
Вправа 5 Сплав міді й алюмінію масою 15 г обробили надлишком хлоридної кислоти й добули водень об’ємом 13,44 л (н. у.). Обчисліть масові частки металів у сплаві.
Відомо: m(сплаву)=15 г, V(H2)=13,44 л
Знайти: w(Al)-?, w(Cu)-?
Розв'язування
v(H2)=V(H2):VM=13,44 л : 22,4 л/моль=0,6 моль
У суміші сплаву тільки алюміній реагує з хлоридною кислотою, тому
запишемо рівняння реакції:
2Al + 6HCl = 2AlCl3 + 3H2↑
За рівнянням реакції v(Al):v(H2)=2:3, тому
v(Al)=2•v(H2):3=2•0,6 моль:3=0,4 моль
M(Al)=27 г/моль
m(Al)=v(Al)•M(Al)=0,4 моль•27 г/моль=10,8 г
w(Al)=m(Al):m(сплаву)=10,8 г:15 г=0,72, або 72%
w(Cu)=100%-w(Al)=100%-72%=28%
Відповідь: 72% алюмінію і 28% міді
Вправа 6 На початку XX ст. взаємодією алюмінію з розчином лугу добували водень, яким заповнювали дирижаблі. Обчисліть відносний вихід водню об’ємом 295,68 л (н.у.),для добування якого було взято алюміній масою 270 г
Відомо: m(Al)=270 г, Vпракт.(H2)=295,68 л
Знайти: η-?
Розв'язування
M(Al)=27 г/моль
v(Al)=m(Al):M(Al)=270 г : 27 г/моль=10 моль
Записуємо рівняння реакції:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
За рівнянням реакції v(Al):v(H2)=2:3, тому
v(H2)=3•v(Al):2=3•10 моль:2=15 моль
Vтеор.(H2)=v(H2)•Vm=15 моль•22,4 л/моль=336 л
η=Vпракт.(H2):Vтеор.(H2)=295,68 л : 336 л=0,88, або 88%
Відповідь: 88%