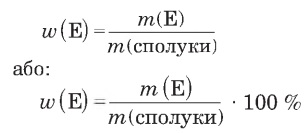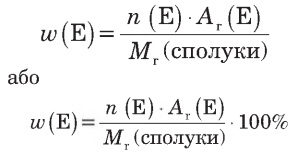![]()
Початковий рівень
Вправа 1 Що називають масовою часткою хімічного елемента у сполуці?
Масова частка елемента у сполуці — це величина, що показує відношення маси елемента до відповідної маси сполуки.
Вправа 2 Запишіть формули для обчислення масової частки елемента у речовині.
|
w(E) — масова частка елемента у речовині, m(E) — маса елемента в речовині, m(сполуки) — маса сполуки. |
|
n(Е) — кількість атомів хімічного елемента Е у молекулі чи формульній одиниці, Аr(Е) — відносна атомна маса елемента, Мr(сполуки) — відносна молекулярна (або формульна) маса хімічної речовини. |
Середній рівень
Вправа 3 Визначте масові частки хімічних елементів у молекулі SO2.
Mr(SO2) = Ar(S)+2•Ar(O)=32+2•16=64
w(S)= Ar(S)/Mr(SO2)=32:64=0,5, або,
помноживши це число на 100%, одержимо 50%
w(О)=2•Ar(О)/Mr(SO2)=2•16:64=0,5, або 50%
Масову частку Оксигену можна знайти ще так:
w(О)=1-w(S)=1-0,5=0,5
чи так:
w(О)=100%-ω(S)=100%-50%=50%
Відповідь: w(S)=0,5, або 50%; w(О)=0,5, або 50%
Вправа 4 184 г мінералу доломіту містить 24 г Маґнію та 40 г Кальцію. Які масові частки цих елементів в доломіті?
Відомо: m(сполуки)=184 г, m(Mg)=24 г, m(Ca)=40 г
Знайти: w(Mg)-?, w(Ca)-?
Розв'язування
w(Mg)=m(Mg):m(сполуки)=24 г : 184 г=0,1314, або,
помноживши це число на 100%, одержуємо 13,14%
w(Са)=m(Са):m(сполуки)=40 г : 184 г=0,2174, або 21,74%
Відповідь: w(Mg)=13,14%, w(Са)=21,74%
Достатній рівень
Вправа 5 Обчисліть масові частки елементів у таких речовинах:
A) калій нітраті KNO3;
Mr(KNO3)=Ar(K)+Ar(N)+3•Ar(O)=39+14+3•16=101
w(K)=Ar(K)/Mr(KNO3)=39:101=0,3861, або 38,61%
w(N)=Ar(N)/Mr(KNO3)=14:101=0,1386, або 13,86%
w(O)=100%-w(H)-w(S)=100%-38,61%-13,86%=47,53%
Відповідь: w(K)=38,61%, w(N)=13,86%, w(O)=47,53%
Б) натрій гідроґенсульфаті NaHSO4.
Mr(NaHSO4)=Ar(Na)+Ar(H)+Ar(S)+4•Ar(O)=23+1+32+4•16=120
w(Na)=Ar(Na)/Mr(NaHSO4)=23:120=0,1917, або 19,17%
w(H)=Ar(H)/Mr(NaHSO4)=1:120=0,0083, або 0,83%
w(S)=Ar(S)/Mr(NaHSO4)=32:120=0,2667, або 26,67%
w(O)=100%-w(Na)-w(H)-w(S)=100%-19,17%-0,83%-26,67%=53,33%
Відповідь: w(Na)=19,17%, w(H)=0,83%, w(S)=26,67%, w(O)=53,33%
B) барій карбонаті ВаСO3.
Mr(BaCO3)=Ar(Ba)+Ar(C)+3•Ar(O)=137+12+3•16=197
w(Ba)=Ar(Ba)/Mr(BaCO3)=137:197=0,6954, або 69,54%
w(C)=Ar(C)/Mr(BaCO3)=12:197=0,0609, або 6,09%
w(O)=100%-w(Ba)-w(C)=100%-69,54,%-0,0609%=24,37%
Відповідь: w(Ba)=69,54%, w(C)=6,09%, w(O)=24,37%
Вправа 6 Певна кількість силікатної кислоти H2SiO3 складається з 1 г Гідроґену, 14 г Силіцію і 24 г Оксиґену. Обчисліть масові частки хімічних елементів у силікатній кислоті.
Відомо: m(H)=1 г, m(Si)=14 г, m(O)=24 г
Знайти: w(H)-?, w(Si)-?, w(O)-?
Розв'язування
1. Розраховуємо масу силікатної кислоти:
m(H2SiO3)=m(H)+m(Si)+m(O)=1 г + 14 г + 24 г=39 г
2. Обчислюємо масові частки хімічних елементів у силікатній кислоті:
w(H)=m(H):m(H2SiO3)=1 г : 39 г=0,0254, або 2,54%
w(Si)=m(Si):m(H2SiO3)=14 г : 39 г=0,3589, або 35,89%
w(O)=m(O):m(H2SiO3)=24 г : 39 г=0,6153, або 61,54%
Відповідь: w(H)=2,14%, w(Si)=35,89%, w(O)=61,54%
Високий рівень
Вправа 7 Розташуйте формули речовин, не здійснюючи обчислень, в порядку зменшення масової частки Калію: КСlO3, КClO, КСl, КСlO4.
Відповідь: KCl, KClO, KClO3, KClO4
З формули обчислення масової частки елемента у сполуці, видно, що масова частка елемента (при однаковій кількості атомів цього елемента у формульній одиниці) тим більша, чим менша формульна маса речовини. Користуємось правилом: з двох дробів, у яких однакові чисельники, меншим буде той дріб, у якого знаменник більший.
Вправа 8 Яка маса Маґнію міститься в 300 г маґній оксиду MgO, якщо масова частка Маґнію в цій сполуці становить 60%?
Відомо: m(MgO)=300 г, w(Mg)=60%
Знайти: m(Mg)-?
Розв'язування
m(Mg)=w(Mg)•m(MgO):100%=60% • 300 г : 100% г=180 г
Відповідь: 180 г
Додаткове завдання
Вправа 9 У зразку залізної руди масова частка Феруму у вигляді мінералу магнетиту Fe3O4 становить 60%. Яка масова частка магнетиту у цій руді?
Відомо: w(Fe)=60%
Знайти: w(Fe3O4)-?
Розв'язування
Припустимо, що маса залізної руди становить 100 г, тобто m(руди)=100 г
1. Знаходимо масу Феруму в залізній руді:
m(Fe)=w(Fe)•m(руди):100%=60% • 100 г : 100%=60 г
2. Знаходимо масову частку Феруму в мінералі магнетиті.
Mr(Fe)=Ar(Fe)=56, Mr(Fe3O4)=3•Ar(Fe)+4•Ar(O)=3•56+4•16=232
w(Fe)=3•Ar(Fe):M(Fe3O4)=3•56:232=0,7241
3. Визначаємо масу магнетиту, що містить 60 г Феруму.
m(Fe3О4)=m(Fe):w(Fe)=60 г : 0,7241=82,85 г
4. Визначаємо масову частку магнетиту в руді.
w(Fe3О4)=(m(Fe3O4):m(руди))•100%=(82,86 г : 100 г)•100%=82,86%
Відповідь: 82,86%
Вправа 10 Обчисліть масу манґану, який можна добути із 20 т руди, що містить 14% манґан (IV) оксиду МnO2.
Відомо: w(MnO2)=14%, або 0,14; m(руди)=20 т
Знайти: m(Mn)-?
Розв'язування
І спосіб
1. З формули обчислення масової частки оксиду MnO2 в складі руди знаходимо масу оксиду:
m(MnО2)=w(MnO2)•m(руди)=0,14 • 20 т=2,8 т
2. З формули обчислення масової частки елемента в сполуці знаходимо масову частку елемента.
Mr(Mn)=Ar(Mn)=55, Mr(MnO2)=Ar(Mn)+2•Ar(O)=55+2•16=87
w(Mn)=Ar(Mn):M(MnO2)=55:87=0,6322
3. З формули обчислення масової частки елемента в сполуці знаходимо масу елемента:
m(Mn)=w(Mn)•m(MnO2)=0,6322•2,8 т=1,77 т
ІІ спосіб
1. За допомогою пропорції визначаємо масу оксиду. Те, що масова частка MnO2 cтановить 14% означає, що:
у 100 г руди міститься 14 г MnO2
у 20000000 г руди ― х г MnO2.
100 г / 20000000 г = 14 г / х г,
х г • 100 г = 14 г • 20000000 г
х = 20000000 г • 14 г : 100 г= 2800000 г=2,8 т
2. Знаходимо відносну молекулярну масу оксиду.
Mr(MnO2)=Ar(Mn)+2•Ar(O)=55+2•16=87
3. Прирівняємо формули обчислення масової частки елемента в сполуці і виразимо масу мангану:
w(Mn)=Ar(Mn)/Mr(MnO2) і w(Mn)=m(Mn)/m(MnO2), тому
Ar(Mn)/Mr(MnO2)=m(Mn)/m(MnO2), за властивістю пропорції
m(Mn)•Mr(MnO2)=m(MnO2)•Ar(Mn), звідси
m(Mn)=m(MnO2)•Ar(Mn):Mr(MnO2)=2,8 т • 55 : 87=1,77 т
Відповідь: 1,77 т
Вправа 11 Установіть хімічну формулу речовини, яка складається із 40% Кальцію, 12% Карбону і 48% Оксиґену.
Відомо: сполука СaхCуOz, w(Сa)=40%, w(C)=12%, w(O)=48%
Знайти: формулу CaxCyOz-?
Розв'язування
Знаходимо співвідношення атомів Кальцію, Карбону і Оксигену в сполуці як ділення числових значень масових часток хімічних елементів, які входять до складу даної сполуки, на їхні відносні атомні маси:
х:у:z=w(Сa)/Ar(Сa) : w(C)/Ar(C): w(O)/Ar(O)=40/40 : 12/12 : 48/16=
=1:1:3
Відповідь: СaCO3
Для тих, хто хоче знати більше. Покажемо, чому відношення кількості атомів знаходять як ділення числових значень масових часток хімічних елементів, які входять до складу даної сполуки, на їхні відносні атомні маси:
З формул обчислення масових часток елементів у сполуці:
w(елемента1)=х•Ar(елемента1)/Mr(сполуки) и w(елемента2)=y•Ar(елемента2)/Mr(сполуки),
виразимо кількість атомів:
x=(w(елемента1)•Mr(сполуки))/Ar(елемента1) і
y=(w(елемента2)•Mr(сполуки))/Ar(елемента2)
і обчислимо їх співвідношення:
x:y=w(елемента1)/Ar(елемента1):w(елемента2)/Ar(елемента2)