Завдання 16.1
Прочитайте опис дослідження в підручнику та виконайте дослід.
1. Зважте пляшку з прикріпленою повітряною кулькою.
Маса до початку реакції дорівнює 50 г + 5 г = 55 г
2.Змішайте речовини.
Маса після закінчення реакції дорівнює 50 г + 5 г = 55 г
3. Сформулюйте гіпотезу, яка пояснить спостереження та результати вимірювання.
Маса до реакції і після реакції однакова, бо виконується закон збереження маси в хімічних реакціях.
4. Спрогнозуйте, чи зміняться результати дослідження, якщо соду засипати без використання повітряної кульки, безпосередньо в пляшку. Маса зменшиться, бо під час "гашення" харчової соди відбувається хімічна реакція з утворенням вуглекислого газу — безбарвної газуватої речовини, що виділяється з пляшки в повітря.
Завдання 16.2
У наведених описах хімічних реакцій назви реагентів підкресліть однією рискою, а продуктів реакції — двома.
1. Активоване вугілля — майже чистий Карбон — реагує з киснем. Унаслідок реакції утворюється вуглекислий газ.
2. Під час взаємодії метану (основний компонент природного газу) з киснем утворюються вода й вуглекислий газ.
Завдання 16.3
1. Унаслідок реакції водню з киснем утворюється вода Н2О.
H2 + 2O2 = 2H2O
Сторінка 74
2. Залізо Fe реагує з киснем і водяною парою, що є в повітрі, і вкривається іржею, основною складовою якої є речовина з формулою Fe(OH)3.
4Fe + 6H2O + 3O2 = 4Fe(OH)3
3. Унаслідок розкладання сахарози C12H22O11 утворюються вугілля С і вода H2O.
C12H22O11 = 12C + 11H2O
Завдання 16.4
Запишіть хімічні рівняння за зображеннями моделей хімічних реакцій.
1. N2 + 3H2 = 2NH3
2. 2Li + 2H2O = 2LiOH + H2
3. 2Na + Cl2 = 2NaCl
Завдання 16.5
Перетворіть схеми реакцій на хімічні рівняння.
|
1) 2Al + 3Br2 = 2AlBr3 3Pb + 2O2 = Pb3O4 4FeO + O2 = 2Fe2O3 |
2) 2SO2 + O2 = 2SO3 4Li + 2O2 = 2Li2O 4Fe + 3O2 = 2Fe2O3 |
Сторінка 75
|
3) 2BaO2 = 2BaO + O2 2H2O2 = 2H2O + O2 2N2O5 = 2NO2 + 3O2 |
4) 2Fe + 3Cl2 = 2FeCl3 2Na + Br2 = 2NaBr 4P + 5O2 = 2P2O5 |
|
5) Zn + 2HCl = ZnCl2 + H2 2C2H6 + 7O2 = 4CO2+ 6H2O PbCl2 + Na2S = PbS+ 2NaCl |
|
|
6) Al(OH)3 + 3HCl = AlCl3 + 3H2O 2H2S + SO2 = 2S + 2H2O P2O5 + 3H2O = 2H3PO4 |
|
|
7) 2KClO3 = 2KCl + 3O2 2FeCl2 + Cl2 = 2FeCl3 2FeCl3 + 3Br2 = 2FeBr3 + 3Cl2 |
|
|
8) 2Fe(OH)3 = Fe2O3 + 3H2O 2Al2O3 + 3H2SO4 = 2Al2(SO4)3 + 3H2O Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O |
|
Завдання 16.6
Запповніть рівняння реакції та таблицю числовою інформацією.
2CH4 + 3O2 = 2CO2 + 4H2O
3CH4 + 6O2 = 3CO2 + 6H2O
| Реагують | Утворюються | ||
| молекул СН4 | молекул О2 | молекул CO2 | молекул H2O |
| 2 | 3 | 2 | 4 |
| 3 | 6 | 3 | 6 |
Завдання 16.7
Складіть рівняння реакцій утворення з простих речовин таких сполук:
а) чадного газу CO; 2C + O2 = 2CO
б) магній оксиду MgO; 2Mg + O2 = 2MgO
Сторінка 76
в) кальцій фосфіду Ca3P2; 3Ca + 2P = Ca3P2
г) алюміній оксиду Al2O3; 4Al + 3O2 = 2Al2O3
д) цинк оксиду; 2Zn + O2 = 2ZnO
Завдання 16.8
На малюнку зображена схема горіння метану.
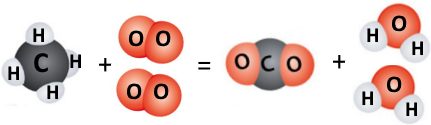 |
|||
| m = 8 г | m = 32 г | m = ? г | m = 18 г |
Складіть рівняння цієї реакції. Обчисліть невідому масу речовини.
Рівняння горіння горіння метану: CH4 + 2O2 = CO2 + 2H2O
Маса речовини: m(CO2) = m(CH4) + m(O2) – m(H2O) = 8 г + 32 г – 18 г = 22 г
Завдання 16.9
Унаслідок розкладання води під дією електричного струму утворилися водень масою 0,6 г і кисень масою 4,8 г. Складіть рівняння цієї реакції. Обчисліть масу (г) води, що розклалася.
Відомо: m(H2) = 0,6 г, m(O2) = 4,8 г
Знайти: m(H2O)–?
Розв'язання
Складаємо рівняння реакції: 2H2O = 2H2 + O2
За законом збереження маси речовин, маса речовин до реакції дорівнює масі речовин після реакції:
m(H2O) = m(H2) + m(O2) = 0,6 г + 4,8 г = 5,4 г
Відповідь: m(H2O) = 5,4 г.
Завдання 16.10
Унаслідок нагрівання малахіту Cu2H2CO5 масою 111 г він розклався на купрум (2+) оксид CuO масою 80 г, воду H2O масою 9 г і вуглекислий газ CO2. Cкладіть рівняння цієї реакції та обчисліть масу (г) вуглекислого газу.
Відомо: m(Cu2H2CO5) = 111 г, m(CuO) = 80 г, m(H2O) = 9 г
Знайти: m(CO2)–?
Розв'язання
Складаємо рівняння реакції: Cu2H2CO5 = 2CuO + H2O + CO2
За законом збереження маси речовин, маса речовин до реакції дорівнює масі речовин після реакції:
m(Cu2H2CO5) = m(CuO) + m(H2O) + m(CO2), звідси
m(CO2) = m(Cu2H2CO5) – m(CuO) – m(H2O) = 111 г – 80 г – 9 г = 22 г
Відповідь: m(CH2) = 22 г.
Сторінка 77
Завдання 16.11
Унаслідок взаємодії сірки S масою 16 г із залізом Fe утворився ферум(+2) сульфід FeS масою 44 г. Обчисліть масу (г) заліза, яке прореагувало.
Відомо: m(S)=16 г, m(FeS)=44 г
Знайти: m(Fe)–?
Розв'язання
За законом збереження маси речовин, маса речовин до реакції дорівнює масі речовин після реакції:
m(S) + m(Fe) = m(FeS), звідси m(Fe) = m(FeS) – m(S) = 44 г – 16 г = 28 г
Відповідь: m(Fe) = 28 г.
Завдання 16.12
Під час реакції метану масою 8 г із киснем масою 32 г утворився вуглекислий газ масою 22 г і вода. Обчисліть масу (г) води, яка утворилася внаслідок цієї реакції.
Відомо: m(CH4)=8 г, m(O2)=32 г, m(CO2)=22 г
Знайти: m(Н2О)–?
Розв'язання
За законом збереження маси речовин, маса речовин до реакції дорівнює масі речовин після реакції:
m(CH4) + m(O2) = m(CO2) + m(H2O), звідси
m(H2O) = m(CH4) + m(O2) – m(CO2) = 8 г + 32 г – 22 г = 18 г
Відповідь: m(Н2О) = 18 г.
Сторінка 78 – 79
Навчальне дослідження №10 Дослідження залежності маси продукту хімічної реакції від часу перебігу дивись тут...