У підручнику 2024 року видання
§ 19 Хімія і математика: масова частка хімічного елемента в речовині
Завдання 1
1) Що таке масова частка хімічного елемента у складній речовині? Масова частка хімічного елемента в складній речовині — це відношення його маси до маси речовини.
2) За якою формулою обчислюють масову частку хімічного елемента у складній речовині? m(E)=m(речовини)•w(E)
3) Людям яких професій потрібні відомості про масові частки хімічних елементів?
Геологам, металургам, щоб кількісно схарактеризувати вміст хімічного елемента в речовині, корисного складника в мінералі.
Агрономам, щоб кількісно схарактеризувати вміст поживного елемента у добриві.
Фармацевтам, щоб кількісно схарактеризувати вміст корисного складника у ліках.
Споживачевіі, щоб кількісно схарактеризувати вміст корисних речовин для здоров’я людини в харчових продуктах.
4) Для чого масову частку виражають у відсотках? Для зручності в користуванні.
5) На якому графіку (мал. 19.8) правильно відображено залежність масової частки хімічного елемента в речовині від її маси? Між масовою часткою хімічного елемента і його масою існує прямопропорційна залежність, тому правильно відображено на графіку 3.
Завдання 2
Порівняй, не вдаючись до обчислень, масові частки:
а) Фосфору у сполуках Р2О3 і Р2О5; Більша у сполуці Р2О3, бо меншою є її відносна молекулярна маса.
б) Нітрогену у сполуках NН3 і NН4Сl; Більша у сполуці NH3, бо меншою є її відносна молекулярна маса.
в) Сульфуру у сполуках Н2S, Н2SО3 й Н2SО4. Найбільша у сполуці H2S, бо найменшою є її відносна молекулярна маса.
Завдання 3
Визнач, не вдаючись до обчислень, із яких рудних мінералів однакової маси — куприту Cu2O чи малахіту Cu2(CO3)(OH)2 — можна видобути більше міді. Більше міді можна видобути з куприту Cu2O, бо меншою є молекулярна маса цієї сполуки, адже містить меншу кількість хімічних елементів.
Завдання 4
Обчисли масові частки хімічних елементів у речовинах, формули яких СS2, С6Н12О6, NaСl, Сu(ОН)2, Fe2(SО4)3.
CS2
Mr(CS2)=Ar(C)+2•Ar(S)=12+2•32=76
w(C)=Ar(C)/Mr(CS2)=12:76=0,158, або,
помноживши результат на 100%, одержимо 15,8%
Масову частку Сульфуру можна знайти так:
w(S)=100%–w(C)=100%–15,8%=84,2%
або так:
w(S)=1–w(C)=1–0,158=0,842
чи так:
w(S)=2•Ar(S)/Mr(CS2)=2•32:76=0,842, або 84,2%
С6Н1206
Mr(C6H12O6)=6•Ar(C)+12•Ar(H)+6•Ar(O)=6•12+12•1+6•16=180
w(С)=6•Ar(С)/Mr(C6H12O6)=6•12:180=0,4, або 40%
w(H)=12•Ar(H)/Mr(C6H12O6)=12•1:180=0,067, або 6,7%
w(O)=100%–w(C)–w(H)=100%–40%–6,7%=53,3%
NaCl
Mr(NaCl)=Ar(Na)+Ar(Cl)=23+35,5=58,5
w(Na)=Ar(Na)/Mr(NaCl)=23:58,5=0,393, або 39,3%
w(Cl)=100%–w(Na)=100%–39,3%=60,7%
Cu(OH)2
Mr(Cu(OH)2)=Ar(Cu)+2•Ar(O)+2•Ar(H)=64+2•16+2•1=98
w(Cu)=Ar(Cu)/Mr(Cu(OH)2)=64:98=0,65, або 65%
w(O)=2•Ar(O)/Mr(Cu(OH)2)=2•16:98=0,33, або 33%
w(H)=100%–w(Cu)–w(O)=100%–65%–33%=2%
Fe2(SO4)3
Mr(Fe2(SO4)3)=2•Ar(Fe)+3•Ar(S)+12•Ar(O)=2•56+3•32+12•16=400
w(Fe)=2•Ar(Fe)/Mr(Fe2(SO4)3)=2•56:400=0,28, або 28%
w(S)=3•Ar(S)/Mr(Fe2(SO4)3)=3•32:400=0,24, або 24%
w(O)=100%–w(Fe)–w(S)=100%–28%–24%=48%
Завдання 5
Обчисли масові частки Нітрогену в добривах (мал. 19.9) і порівняй їх із зазначеними на пакованні. Висунь припущення щодо можливих причин результатів порівняння. Визнач, у яких двох зображених пакованнях маса Нітрогену приблизно однакова. Добери до назви (1–4) добрива (мал. 19.9) стовпчик (А–Е) діаграми (мал. 19.10).
1) На пакуванні: карбамід w(NH2CONH2)=46,2% і маса 3 кг;
Mr(NH2CONH2)=2•Ar(N)+4•Ar(H)+Ar(C)+Ar(O)=28+4+12+16=60
w(N)=2•Ar(N)/Mr(NH2CONH2)=2•14:60=0,467, або 46,7%
m(N)=m(NH2CONH2)•w(N):100%=3 кг • 46,7%:100%=1,401 кг = 1401 г
2) На пакуванні: калійна селітра w(KNO3)=13,0% і маса 5 кг;
Mr(KNO3)=Ar(K)+Ar(N)+3•Ar(O)=39+14+48=101
w(N)=Ar(N)/Mr(KNO3)=14:101=0,139, або 13,9%
m(N)=m(KNO3)•w(N):100%=5 кг • 13,9%:100%=0,695 кг = 695 г
3) На пакуванні: аміачна селітра w(NH4NO3)=34,4% і маса 3 кг;
Mr(NH4NO3)=2•Ar(N)+4•Ar(H)+3•Ar(O)=28+4+48=80
w(N)=2•Ar(N)/Mr(NH4NO3)=2•14:80=0,35, або 35%
m(N)=m(NH4NO3)•w(N):100%=3 кг • 35%:100%=1,05 кг = 1050 г
4) На пакуванні: сульфат амонію w((NH4)2SO4)=21,21% і маса 5 кг;
Mr((NH4)2SO4)=2•Ar(N)+8•Ar(H)+Ar(S)+4•Ar(O)=28+8+32+64=132
w(N)=2•Ar(N)/Mr((NH4)2SO4)=2•14:132=0,2121, або 21,21%
m(N)=m((NH4)2SO4)•w(N):100%=5 кг • 21,21%:100%=1,06 кг = 1060 г
Припущення: добрива для різних цілей в агрономіці, мають різну масову частку Нітрогену.
Маса Нітрогену приблизно однакова в пакуваннях 3 і 4.
На графіку 1 (38%) аміачна селітра; на графіку 3 (13%) калійна селітра; на графіку 5 (47%) карбамід; на графіку 6 (23%) сульфат амонію.
Завдання 6
Долучися до дискусій та обґрунтуй свою думку. У яких харчах міститься найбільше кальцію? У молочних продуктах; зелених овочах і фруктах; риба та морепродукти.
Завдання 7
Склади алгоритм обчислення масової частки хімічного елемента в складній речовині й добери до нього приклади.
Алгоритм:
1. У періодичній таблиці шукаємо відносні атомні маси елементів, що є у формулі складної речовини і записуємо їх.
2. Обчислюємо відносну молекулярну масу складної речовини.
3. Обчислюємо за формулою масові частки елементів в складній речовині.
Наприклад, знайти масові частки Карбону і Оксигену, що містяться у вуглекислому газі (CO2):
Mr(CO2)=Ar(C)+2•Ar(O)=12+2•16=44
w(C)=Ar(C)/Mr(CO2)=12:44=0,27, або 27%
w(O)=2•Ar(O)/Mr(CO2)=2•16:44=0,73, або 73%
____________________________________________________________
У підручнику 2015 року видання
§15 Масова частка елемента в речовині
Вправа 1 Що таке масова частка хімічного елемента у складній речовині?
Масова частка хімічного елемента в складній речовині — це відношення його маси до маси речовини (сполуки):
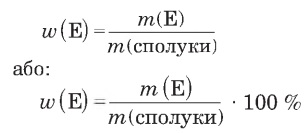
w(E) — масова частка елемента у речовині,
m(E) — маса елемента в речовині,
m(сполуки) — маса сполуки.
Вправа 2 За якою формулою обчислюють масову частку хімічного елемента у складній речовині?
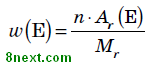
w(E) — масова частка хімічного елемента E, виражена в частках одиниці;
n — число атомів елемента E, позначене індексом у формулі сполуки;
Ar — відносна атомна маса елемента E;
Mr — відносна молекулярна маса речовини
Вправа 3 Представникам яких професій потрібні відомості про масові частки хімічних елементів? Геологам, металургам
Чи потрібні ці знання пересічній людині? Чому? Споживачеві потрібно знати масові частки корисних і шкідливих для здоров’я речовин у харчових продуктах
Вправа 4 Чому масова частка хімічного елемента в сполуці не має одиниці вимірювання? Бо є відношенням двох мас, одиниці вимірювання яких скорочуються
Вправа 5 Для чого масову частку виражають у відсотках? Для зручності
Вправа 6 Порівняйте, не вдаючись до обчислень, масові частки: а) Сульфуру; б) Фосфору; в) Нітрогену в сполуках, хімічні формули яких відповідно:
а) Н2S і Н2SO4
Масова частка Сульфуру більша у сполуці H2S
б) Р2O3 і Р2O5
Масова частка Фосфору більша у сполуці P2O3
в) NH3 і NH4Cl.
Масова частка Фосфору більша у сполуці NH3
З формули обчислення масової частки елемента, видно, що масова частка елемента (при однаковій кількості атомів цього елемента в молекулі) тим більша, чим менша молекулярна маса речовини. Користуємось правилом: з двох дробів, у яких однакові чисельники, більшим буде той дріб, у якого знаменник менший
Вправа 7 Обчисліть масові частки хімічних елементів у речовинах, формули яких:
CS2
Mr(CS2)=Ar(C)+2•Ar(S)=12+2•32=76
w(C)=Ar(C)/Mr(CS2)=12:76=0,158, або,
помноживши це число на 100%, одержимо 15,8%
Масову частку Сульфуру можна знайти так:
w(S)=100%–w(C)=100%–15,8%=84,2%
або так:
w(S)=1–w(C)=1–0,158=0,842
чи так:
w(S)=2•Ar(S)/Mr(CS2)=2•32:76=0,842, або 84,2%
С6Н1206
Mr(C6H12O6)=6•Ar(C)+12•Ar(H)+6•Ar(O)=6•12+12•1+6•16=180
w(С)=6•Ar(С)/Mr(C6H12O6)=6•12:180=0,4, або 40%
w(H)=12•Ar(H)/Mr(C6H12O6)=12•1:180=0,067, або 6,7%
w(O)=100%–w(C)–w(H)=100%–40%–6,7%=53,3%
NaCl
Mr(NaCl)=Ar(Na)+Ar(Cl)=23+35,5=58,5
w(Na)=Ar(Na)/Mr(NaCl)=23:58,5=0,393, або 39,3%
w(Cl)=100%–w(Na)=100%–39,3%=60,7%
Cu(OH)2
Mr(Cu(OH)2)=Ar(Cu)+2•Ar(O)+2•Ar(H)=64+2•16+2•1=98
w(Cu)=Ar(Cu)/Mr(Cu(OH)2)=64:98=0,65, або 65%
w(O)=2•Ar(O)/Mr(Cu(OH)2)=2•16:98=0,33, або 33%
w(H)=100%–w(Cu)–w(O)=100%–65%–33%=2%
Fe2(SO4)3
Mr(Fe2(SO4)3)=2•Ar(Fe)+3•Ar(S)+12•Ar(O)=2•56+3•32+12•16=400
w(Fe)=2•Ar(Fe)/Mr(Fe2(SO4)3)=2•56:400=0,28, або 28%
w(S)=3•Ar(S)/Mr(Fe2(SO4)3)=3•32:400=0,24, або 24%
w(O)=100%–w(Fe)–w(S)=100%–28%–24%=48%