© 8next.com (відповіді, перероблене і доповнене)
У підручнику 2024 року видання
§19 Масова частка хімічного елемента у складній речовині
Відомо: m(речовини) = 20 г, m(Br) = 16 г
Знайти: w(Br) — ?
Розв'язання
w(Br) = m(Br)/m(речовини) = 16/20 г = 0,8,
помноживши отримане значення на 100%, одержимо 80%
Відповідь: w(Br) = 0,8, або 80%.
Ar(S)=32; Ar(O)=16; Mr(SO2)=Ar(S)+2•Ar(O)=32+2•16=32+32=64
w(S)=Ar(S)/Mr(SO2)=32:64=0,5, або 50%
Масову частку Оксигену можна знайти
так:
w(O)=2•Ar(O)/Mr(SO2)=2•16:64=0,5, або 50%
або
w(O)=100% – w(S)=100%–50%=50%
чи
w(O)=1 – w(S)=1–0,5=0,5
SiH4
Ar(Si)=28; Ar(H)=1; Mr(SiH4)=Ar(Si)+4•Ar(H)=28+4•1=32
w(Si)=Ar(Si)/Mr(SiH4)=28:32=0,875, або 87,5%
w(H)=4•Ar(H)/Mr(SiH4)=4•1:32=0,125, або 12,5%
CrO3.
Ar(Cr)=52; Ar(O)=16; Mr(CrO3)=Ar(Cr)+3•Ar(O)=52+3•16=100
w(Cr)=Ar(Cr)/Mr(CrO3)=52:100=0,52, або 52%
w(O)=100%-w(Cr)=100%-52%=48%
Ar(C)=12; Ar(H)=1; Ar(O)=16;
Mr(C6H12O6)=6•Ar(C)+12•Ar(H)+6•Ar(O)=6•12+12•1+6•16=72+12+96=180
w(C)=6•Ar(C)/Mr(C6H12O6)=6•12:180=0,4, або 40%
w(H)=12•Ar(H)/Mr(C6H12O6)=12•1:180=0,067, або 6,7%
w(O)=6•Ar(O)/Mr(C6H12O6)=6•16:180=0,533, або 53,3%
Відомо: w(A) = 5%, m(cполуки) = 80 г
Знайти: m(A) — ?
Розв'язання
m(A) = m(сполуки) • w(A) : 100% = 80 г • 5% : 100% = 4 г
Відповідь: 4 г.
Вправа 139
Як обчислити масову частку хімічного елемента у сполуці, якщо відома її хімічна формула?
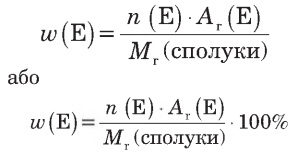
Вправа 140
У крейді масою 50 г міститься Кальцій, маса якого становить 20 г. Обчисліть (усно) масову частку цього елемента в речовині, виразивши її звичайним дробом, десятковим дробом та у відсотках.
Відомо: m(крейди) = 50 г, m(Са) = 20 г
Знайти: w(Са) — ?
Розв'язання
w(Са) = m(Са)/m(крейди) = 20/50 г = 2/5 = 0,4 (або 40%)
Відповідь: w(Са) = 2/5, або 0,4, або 40%.
Вправа 141
Виконайте обчислення для оцтової кислоти СН3СООН та гліцерину С3Н5(ОН)3 і заповніть таблицю:
|
Формула сполуки |
Mr (сполуки) |
w(С) | w(Н) | w(O) |
| СН3СООН | 60 |
40% |
7% |
53% |
| С3Н5(ОН)3 | 92 |
39% |
9% |
52% |
Обчислення для СН3СООН:
Mr(СН3СООН)=2•Ar(C)+4•Ar(Н)+2•Ar(O)=2•12+4•1+2•16=60
w(C)=2•Ar(C)/Mr(СН3СООН)=2•12:60=0,4, або 40%
w(О)=2•Ar(O)/Mr(СН3СООН)=2•16:60=0,53, або 53%
w(Н)=100%–w(C)–w(О)=100%–40%–53%=7%
Обчислення для С3Н5(ОН)3:
Mr(С3Н5(ОН)3)=3•Ar(C)+8•Ar(Н)+3•Ar(O)=2•12+4•1+2•16=92
w(C)=3•Ar(C)/Mr(С3Н5(ОН)3)=3•12:92=0,39, або 39%
w(О)=3•Ar(O)/Mr(С3Н5(ОН)3)=3•16:92=0,52, або 52%
w(Н)=100%–w(C)–w(О))=100%–39%–52%=9%
Вправа 142
Обчисліть кількість атомів Оксигену в молекулі SOx, якщо масова частка цього елемента у відповідній сполуці становить 0,6.
Відомо: сполука SOx, w(О)=0,6
Знайти: x–?
Розв'язання
Ar(S)=32, Ar(O)=16, Mr(SOx)=Ar(S)+x•Ar(O)=32+16x
Підставимо значення у формулу обчислення масової частки Оксигену в сполуці w(O)=x•Ar(O):Mr(SOx),
отримаємо рівняння і розв'язуємо його:
0,6 = 16х/(32+16х)
0,6(32 + 16х) = 16х
19,2 + 9,6х = 16х
16х – 9,6х = 19,2
6,4х = 19,2
х = 19,2 : 6,4
х = 3
Відповідь: три атоми Оксигену у формулі SO3.
Вправа 143
Масова частка Кальцію в його сполуці з Гідрогеном становить 0,952. Обчисліть маси Кальцію та Гідрогену, які містяться в сполуці масою 20 г.
Відомо: w(Са) = 0,952, m(сполуки) = 20 г
Знайти: m(Ca)–?, m(Н)–?
Розв'язування
1–ий спосіб
Обчислюємо масу Кальцію:
m(Са) = w(Са) • m(сполуки) = 0,925 • 20 г = 19,04 г
Обчислюємо масу Гідрогену:
m(Н) = m(сполуки) – m(Ca)=20 г – 19,04 г = 0,96 г
2–ий спосіб
Обчислюємо масу Кальцію:
m(Са) = w(Са) • m(сполуки) = 0,925 • 20 г = 19,04 г
Обчислюємо масову частку Гідрогену у сполуці:
w(Н) = 1 – w(Са) = 1 – 0,952 = 0,048
Обчислюємо масу Гідрогену:
m(Н) = w(Н) • m(сполуки) = 0,048 • 20 г = 0,96 г
Відповідь: 19,04 Кальцію і 0,96 г Гідрогену.
Вправа 144
У кухонній солі, яка тривалий час перебувала у вологому повітрі, масова частка води становила 1%. Обчисліть масову частку Натрію в цій солі, якщо її хімічна формула NaCl.
Відомо: w(H2O) = 1%
Знайти: w(Na)–?
Розв'язування
Знаходимо масову частку кухонної солі у водяній парі.
w(NaCl) = 100% – w(H2O) = 100% – 1% = 99%
Знаходимо масову частку Натрію в кухонній солі.
Ar(Na) = 23, Ar(Cl) = 35,5, Mr(NaCl) = Ar(Na) + Ar(Cl) = 23 + 35,5 = 58,5
23 — x%
58,5 — 99%
23/58,5 = x/99; 58,5x = 2277; x = 2277 : 58,5; x= 38,9%
Відповідь: 38,9%.
Вправа 145
Зіставляючи формули речовин, а також значення відносних атомних мас, з’ясуйте, у якій із двох речовин масова частка першого у формулі хімічного елемента більша:
а) N2O, NO;
Ar(N)=14; Ar(O)=16;
Mr(N2О)=2•Ar(N)+Ar(O)=2•14+16=44
w1(N)=2•Ar(N)/Mr(N2О)=2•14:44=0,63, або 63%
Mr(NО)=Ar(N)+Ar(O)=14+16=30
w2(N)=Ar(N)/Mr(NО)=14:30=0,47, або 47%
Відповідь: масова частка Нітрогену у першій речовині більша.
в) В2O3, В2S3;
Ar(В)=11; Ar(O)=16; Ar(S)=32
Mr(B2О3)=2•Ar(B)+3•Ar(O)=2•11+3•16=70
w1(B)=2•Ar(B)/Mr(B2О3)=2•11:70=0,314, або 31,4%
Mr(B2S3)=2•Ar(B)+3•Ar(S)=2•11+3•32=118
w2(B)=2•Ar(B)/Mr(B2S3)=2•11:118=0,186, або 18,6%
Відповідь: масова частка Бору у першій речовині більша.
б) СО, СО2;
Ar(С)=12; Ar(O)=16
Mr(СО)=Ar(С)+Ar(O)=12+16=28
w1(С)=Ar(С)/Mr(СО)=12:28=0,42, або 42%
Mr(СО2)=Ar(С)+2•Ar(О)=12+2•16=44
w2(С)=Ar(С)/Mr(СО2)=12:44=0,27, або 27%
Відповідь: масова частка Карбону у першій речовині більша.
г) Pb3O4, PbO.
Ar(Pb)=207; Ar(O)=16
Mr(Pb3O4)=3•Ar(Pb)+4•Ar(O)=3•207+4•16=685
w1(Pb3O4)=3•Ar(Pb)/Mr(Pb3O4)=3•207:685=0,91, або 91%
Mr(PbО)=Ar(Pb)+Ar(O)=207+16=223
w2(PbO)=Ar(Pb)/Mr(PbО)=207:223=0,928, або 92,8%
Відповідь: масова частка Плюмбуму у другій речовині більша.
Вправа 146
Речовина, яку використовують як азотне добриво (мал. 66), має формулу NH4NO3. З’ясуйте, чи є добриво чистою речовиною, порівнявши значення масової частки Нітрогену на пакеті з обчисленим за хімічною формулою речовини.
Відомо: w(N)=84,4%
Знайти: зразок є чистою сполукою–?
Розв'язування
Mr(NH4NO3)=2•Ar(N)+4•Ar(H)+3•Ar(O)=2•14+4•1+3•16=28+4+48=80
w(N)=2•Ar(N)/Mr(NH4NO3)=2•14:80=0,35, або 35%
Те, що масова частка елемента у сполуці становить 35% означає, що у 100 г сполуки міститься 35 г Нітрогену. Оскільки на пакеті у 100 г сполуки міститься 34,4 г Нітрогену, очевидно, що маса Нітрогену практично однакова, тому добриво є чистою речовиною.
Відповідь: добриво є чистою речовиною.
Завдання 147
Випишіть з тексту параграфа кілька ключових слів і словосполучень.
Масова частка — mass fraction, маса хімічного елемента — mass of a chemical element, кількісний вміст — quantitative content.
_________________________________________________
У підручниках 2015 і 2020 року видання
§16 (2015) / §18 (2020) МАСОВА ЧАСТКА ЕЛЕМЕНТА У СКЛАДНІЙ РЕЧОВИНІ
Вправа 115 / 125 (2020) Як обчислити масову частку елемента у сполуці, якщо відомі:
а) маса елемента і відповідна маса сполуки;
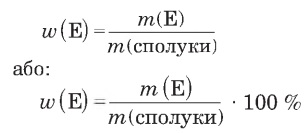
w(E) — масова частка елемента у речовині,
m(E) — маса елемента в речовині,
m(сполуки) — маса сполуки.
б) хімічна формула сполуки?
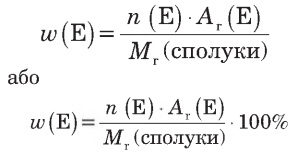
n(Е) — кількість атомів хімічного елемента Е у молекулі чи формульній одиниці,
Аr(Е) — відносна атомна маса елемента,
Мr(сполуки) — відносна молекулярна (або формульна) маса хімічної речовини.
Вправа 116 / 126 (2020) Якою є масова частка елемента у простій речовині?
Рівною 1 або 100%
Вправа 117 / 127 (2020) У 20 г речовини міститься 16 г Брому. Знайдіть масову частку цього елемента в речовині, виразивши її звичайним дробом, десятковим дробом й у відсотках.
Відомо: m(речовини)=20 г, m(Br2)=16 г
Знайти: w(Br)–?
Розв'язування
w(Br)=m(Br2)/m(речовини)=16 г / 20 г=4/5=0,8, або 80%
Відповідь: 4/5, або 0,8, або 80%
Вправа 118 / 128 (2020) Обчисліть (бажано усно) масові частки елементів у сполуках, що мають такі формули:
a) SO2
Mr(SO2)=Ar(S)+2•Ar(O)=32+2•16=64
w(S)=Ar(S)/Mr(SO2)=32:64=0,5, або 50%
w(О)=2•Ar(O)/Mr(SO2)=2•16:64=0,5, або 50%
Інший варіант розрахунку масової частки Оксигену:
w(O)=1–w(S)=1–0,5=0,5
або
w(O)=100%–w(S)=100%–50%=50%
Відповідь: w(S)=0,5, або 50%; w(O)=0,5, або 50%
б) SiH4
Mr(SіН4)=Ar(Sі)+4•Ar(Н)=28+4•1=32
w(Sі)=Ar(Sі)/Mr(SіН4)=28:32=0,875, або 87,5%
w(Н)=100%–87,5%=12,5%
Відповідь: w(Sі)=87,5%; w(Н)=12,5%
в) CrO3
Mr(CrO2)=Ar(Cr)+2•Ar(O)=52+2•16=84
w(Cr)=Ar(Cr)/Mr(CrO2)=52:84=0,62, або 62%
w(О)=100%–62%=38%
Відповідь: w(Cr)=62%; w(Н)=38%
Вправа 119 / 129 (2020) Виконайте необхідні обчислення для оцтової кислоти СН3СООН та гліцерину С3Н5(ОН)3 і заповніть таблицю:
|
Формула сполуки |
Mr (спо– луки) |
w(С) | w(Н) | w(O) |
| СН3СООН | 60 |
40% |
7% |
53% |
| С3Н5(ОН)3 | 92 |
39% |
9% |
52% |
Для СН3СООН:
Mr(СН3СООН)=2•Ar(C)+4•Ar(Н)+2•Ar(O)=2•12+4•1+2•16=60
w(C)=2•Ar(C)/Mr(СН3СООН)=2•12:60=0,4, або 40%
w(О)=2•Ar(O)/Mr(СН3СООН)=2•16:60=0,53, або 53%
w(Н)=100%–w(C)–w(О)=100%–40%–53%=7%
Для С3Н5(ОН)3:
Mr(С3Н5(ОН)3)=3•Ar(C)+8•Ar(Н)+3•Ar(O)=2•12+4•1+2•16=92
w(C)=3•Ar(C)/Mr(С3Н5(ОН)3)=3•12:92=0,39, або 39%
w(О)=3•Ar(O)/Mr(С3Н5(ОН)3)=3•16:92=0,52, або 52%
w(Н)=100%–w(C)–w(О))=100%–39%–52%=9%
Вправа 120 / 130 (2020) Зіставляючи формули речовин, а також значення відносних атомних мас, визначте, у якій з речовин кожної пари масова частка першого у формулі елемента більша:
а) N2O, NO
Mасова частка Нітрогену у першій сполуці більша, бо у формулі N2О на один атом Оксигену припадає два атоми Нітрогену, а в формулі NO ― один атом Нітрогену.
Ar(N)=14; Ar(O)=16
Mr(N2О)=2•Ar(N)+Ar(O)=2•14+16=44
w1(N)=2•Ar(N)/Mr(N2О)=2•14:44=0,63, або 63%
Mr(NО)=Ar(N)+Ar(O)=14+16=30
w2(N)=Ar(N)/Mr(NО)=14:30=0,46, або 46%
б) СО, СО2
Mасова частка Карбону у першій сполуці більша, бо у формулі СО на один атом Карбону припадає один атом Оксигену, а в формулі СO2 ― два атоми Оксигену.
Ar(С)=12; Ar(O)=16
Mr(СО)=Ar(С)+Ar(O)=12+16=28
w1(С)=Ar(С)/Mr(СО)=12:28=0,42, або 42%
Mr(СО2)=Ar(С)+2•Ar(О)=12+2•16=44
w2(С)=Ar(С)/Mr(СО2)=12:44=0,27, або 27%
в) В2O3, В2S3
Обидві речовини містять однакову кількість атомів Бору, але
Mr(B2О3)<Mr(B2S3), бо Ar(О)<Ar(S), тому масова частка Бору у першій сполуці є більшою.
Ar(В)=11; Ar(O)=16; Ar(S)=32
Mr(B2О3)=2•Ar(B)+3•Ar(O)=2•11+3•16=70
w1(B)=2•Ar(B)/Mr(B2О3)=2•11:70=0,31, або 31%
Mr(B2S3)=2•Ar(B)+3•Ar(S)=2•11+3•32=118
w2(B)=2•Ar(B)/Mr(B2S3)=2•11:118=0,19, або 19%
Зміни 2020 року видання. г) PbO, PbO2, Pb3O4.
Mасова частка Плюмбуму у першій сполуці більша, бо у формулі PbO на один атом Плюмбуму припадає один атом Оксигену, а в формулі PbO2 ― два атоми Оксигену. Mr(PbО)<Mr(Pb3O4) і Ar(Pb)<3•Ar(Pb), тому масова частка Плюмбуму у першій сполуці є найбільшою.
Ar(Pb)=207; Ar(O)=16
Mr(PbО)=Ar(Pb)+Ar(O)=207+16=223
w1(Pb)=Ar(Pb)/Mr(PbО)=207:223=0,93, або 93%
Mr(PbO2)=Ar(Pb)+2•Ar(O)=207+2•16=239
w2(Pb)=Ar(Pb)/Mr(PbO2)=207:239=0,87, або 87%
Mr(Pb3O4)=3•Ar(Pb)+4•Ar(Pb)=3•207+4•16=685
w3(Pb)=3•Ar(Pb)/Mr(Pb3O4)=3•207:685=0,91, або 91%
Вправа 121 / 131 (2020) Масова частка Кальцію в його сполуці з Гідрогеном становить 0,952. Які маси Кальцію та Гідрогену містяться в 20 г сполуки?
Відомо: w(Са)=0,952, m(сполуки)=20 г
Знайти: m(Н)–?
Розв'язування
І спосіб
Обчислюємо масу Кальцію:
m(Са)=w(Са)•m(сполуки)=0,925•20 г=19,04 г
Обчислюємо масу Гідрогену:
m(Н)=m(сполуки)–m(Ca)=20 г – 19,04 г=0,96 г
ІІ спосіб
Обчислюємо масу Кальцію:
m(Са)=w(Са)•m(сполуки)=0,925•20 г=19,04 г
Обчислюємо масову частку Гідрогену у сполуці:
w(Н)=1 – w(Са)=1–0,952=0,048
Обчислюємо масу Гідрогену:
m(Н)=w(Н)•m(сполуки)=0,048•20 г=0,96 г
Відповідь: 19,04 Кальцію і 0,96 г Гідрогену
Вправа 122 / 132 (2020) Масова частка Нітрогену в певній сполуці становить 28%. У якій масі сполуки міститься 56 г Нітрогену?
Відомо: w(N)=28%, або 0,28, m(N)=56 г
Знайти: m(сполуки)–?
Розв'язування
І спосіб
З формули обчислення масової частки Нітрогену в сполуці знаходимо масу сполуки:
m(сполуки)=m(N):w(N)=56 г:0,28=200 г
ІІ спосіб
Для визначення маси сполуки складаємо пропорцію і розв'язуємо її:
Те, що масова частка Нітрогену рівна 28% означає, що
у 100 г сполуки міститься 28 г Нітрогену
у х г сполуки ― 56 г Нітрогену.
100 г / х г = 28 г / 56 г,
х г • 28 г = 56 г • 100 г,
х = 56 г • 100 г : 28 г= 200 г
Відповідь: 200 г
Вправа 123 / 133 (2020) Знайдіть кількість атомів Оксигену в молекулі SOx, якщо масова частка цього елемента у відповідній сполуці становить 0,6.
Відомо: сполука SOx, w(О)=0,6
Знайти: x–?
Розв'язування
І спосіб
Знаходимо масову частку Сульфуру у сполуці:
w(S)=1–w(O)=1–0,6=0,4
Знаходимо співвідношення атомів Сульфуру і Оксигену у сполуці як ділення числових значень масових часток хімічних елементів, які входять до складу даної сполуки, на їхні відносні атомні маси:
w(S)/Ar(S) : w(O)/Ar(O)=0,4/32 : 0,6/16=0,0125:0,0375=1:3
З обчислення видно, що в речовині на один атом Сульфуру припадає три атоми Оксигену.
ІI спосіб
Ar(S)=32, Ar(O)=16, Mr(SOx)=Ar(S)+x•Ar(O)=32+16x
З формули обчислення масової частки Оксигену в сполуці: w(O)=x•Ar(O):Mr(SOx)
знаходимо число атомів Оксигену:
х=w(O)•Mr(SOx):Ar(O)
x=0,6(32+16x):16
16x=0,6(32+16x)
16x=19,2+9,6x
16x–9,6x=19,2
6,4x=19,2
x=19,2:6,4
x=3, отже, 3 атоми Оксигену
Відповідь: 3 атоми Оксигену
Для тих, хто хоче знати більше. Покажемо, чому відношення кількості атомів знаходять як ділення числових значень масових часток хімічних елементів, які входять до складу даної сполуки, на їхні відносні атомні маси:
З формул обчислення масових часток елементів у сполуці:
w(елемента1)=х•Ar(елемента1)/Mr(сполуки) и w(елемента2)=y•Ar(елемента2)/Mr(сполуки),
виразимо кількість атомів:
x=(w(елемента1)•Mr(сполуки))/Ar(елемента1) і
y=(w(елемента2)•Mr(сполуки))/Ar(елемента2)
і обчислимо їх співвідношення:
x:y=w(елемента1)/Ar(елемента1):w(елемента2)/Ar(елемента2)
Вправа 124 / 134 (2020) Масова частка Феруму в зразку сполуки FeO становить 75%. За допомогою обчислень з’ясуйте, чи є цей зразок чистою сполукою.
Відомо: w(Fe)=75%
Знайти: зразок є чистою сполукою–?
Розв'язування
Mr(FeO)=Ar(Fe)+Ar(O)=56+16=72
w(Fe)=Ar(Fe)/Mr(FeO)=56:72=0,78, або 78%
Те, що масова частка елемента у сполуці становить 78% означає, що у 100 г сполуки міститься 78 г Феруму. За умовою задачі у 100 г сполуки міститься 75 г Феруму, очевидно, що його менше, ніж повинно бути, тому зразок не є чистою сполукою.
Відповідь: зразок є з домішками.