![]()
Завдання для самоконтролю
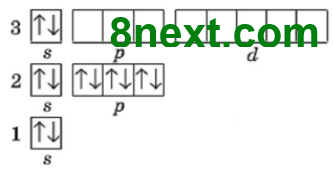
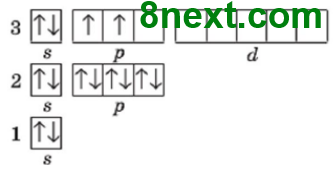
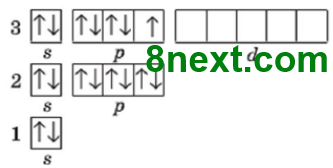
Вправа 1. Запишіть електронні формули атомів Mg, Si, Cl і графічно зобразіть розміщення електронів за енергетичними комірками.
|
Магній Mg 1s22s22p63s2
|
|
Силіцій Si 1s22s22p63s23p2
|
|
Хлор Сl 1s22s22p63s23p5
|
Вправа 2. Максимальне число електронів, які можуть займати 3 s-підрівень, дорівнює:
| А 1 | Б 2 | В 6 | Г 8 |
Третій s-підрівень складається з однієї орбіталі, а на кожній орбіталі максимально можуть розміститися два електрони.
Вправа 3. На зовнішньому енергетичному рівні атома Сульфуру міститься електронів:
| А 2 | Б 4 | В 6 | Г 8 |
Число електронів на зовнішньому енергетичному рівні атома хімічного елемента дорівнює номеру групи. Сульфур є елементом VI групи.
Вправа 4. Скільки завершених енергетичних рівнів міститься в атомах хімічних елементів із протонними числами 4, 10, 17? Відповідь поясніть.
Число енергетичних рівнів дорівнює номеру періоду, в якому перебуває елемент. Усі запропоновані хімічні елементи є елементами головних підгруп, тому в них число електронів на зовнішньому енергетичному рівні дорівнює номеру групи. Всі завершені енергетичні рівні мають елементи головних підгруп VIII групи, у інших елементів завершеними є лише попередні енергетичні рівні, тобто від номера періоду треба відняти одиницю.
Отже, для хімічного елемента:
№ 4 (період 2, група ІІ) - один завершений енергетичний рівень,
№ 10 (період 2, група VIII)- два завершені енергетичні рівні,
№ 17 (період 3, група VII) - два завершені енергетичні рівні.
Вправа 5. Число протонів у ядрі атома Феруму дорівнює:
| А 2 | Б 8 | В 26 | Г 56 |
На число протонів у ядрі атома вказує порядковий номер елемента. Ферум має №26.
Вправа 6. Заповнення електронів р-підрівня відбувається в атомах:
| А Калію | Б Сульфуру | В Гелію | Г Алюмінію |
Заповнення електронів р-підрівня відбувається в атомах головних підгруп ІІІ-VIII груп елементів 2 - 6 періодів.
Вправа 7. Число електронів на зовнішньому електронному р-підрівні атома Хлору дорівнює:
| А 7 | Б 3 | В 5 | Г 6 |
Хлор міститься у головній підгрупі VII групи, тому на останньому енергетичному рівні містить 7 електронів, з них, 2 s-електрони і 5 р-електрони. Електронна конфігурація атома Хлору 1s22s22p63s23p5.
Вправа 8. Елемент, атом якого має конфігурацію 1s22s22p63s23p1 - це
| А Al | Б В | В Cl | Г Na |
Атом має три енергетичні рівні (вказує останній коефіцієнт перед буквою), тому хімічний елемент перебуває у третьому періоді, на останньому енергетичному рівні має три електрони (два s-електрони і один р-електрон), тому є елементом головної підгрупи ІІІ групи. Отже, шуканий елемент - Алюмінй.
Додаткові завдання
Вправа 9. Запишіть електронну конфігурацію атома Калію.
1s22s22p63s23p64s1
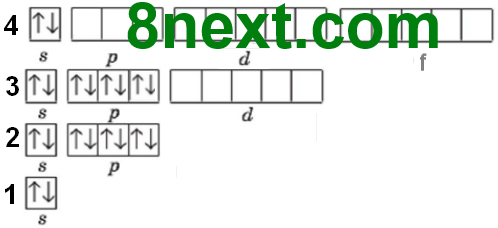
Вправа 10. Електронна конфігурація 1s22s22p63s23p64s2 відповідає атому:
| А Са | Б К | В Sc | Г Ar |
Атом має чотири енергетичні рівні (вказує останній коефіцієнт перед буквою), тому хімічний елемент перебуває у четвертому періоді, на останньому енергетичному рівні має два s-електрони, тому є елементом головної підгрупи ІІ групи. Отже, шуканий елемент - Кальцій.
Складіть схему розподілу цього атома за енергетичними комірками.
Вправа 11. Скорочена електронна конфігурація основного стану ... 3d54s24p0 відповідає атому із зарядом ядра:
| А 20 | Б 25 | В 30 | Г 35 |
Заповнення d-підрівня попереднього енергетичного рівня свідчить про те, що це елемент побічної підгрупи.
Атом має чотири енергетичні рівні (вказує останній коефіцієнт перед буквою), тому хімічний елемент перебуває у четвертому періоді. На останньому енергетичному рівні атома є 7 електронів (5+2+0=7), тому елемент розміщується у VII групі. Отже, запропонована конфігурація відповідає атому із зарядом ядра 25.
Вправа 12. Серед наведених позначень електронних конфігурацій неможливими є:
| А 1р1 | Б 1s2 | В 2d4 | Г 3f2 |
Відповідь мотивуйте. Перший енергетичний рівень (вказує коефіцієнт перед буквою) не містить р-підрівня, другий енергетичний рівень не містить d-підрівня, третій енергетичний рівень не містить f-підрівня.
Вправа 13*. Одну вільну р-орбіталь має на зовнішньому електронному рівні атом:
| А Берилію | Б Алюмінію | В Карбону | Г Скандію |
Запишемо скорочені електронні конфігурації основного стану атомів запропонованих елементів.
Берилій ...2s2, Алюміній ...3s23p1, Карбон ...2s22p2,
Скандій ...3d14s2 (зверніть увагу, що заповнюється d-підрівень попереднього рівня, бо це елемент побічної підгрупи).
Отже, три р-орбіталі на останньому енергетичному рівні мають Алюміній і Карбон, але Алюміній містить один р-електрон, тому вільними є дві р-орбіталі, а Карбон - два р-електрони, тому вільною є одна р-орбіталь.