![]()
Завдання для самоконтролю
Вправа 1. Як ви розумієте суть поняття "хімічний зв'язок"? Атоми різних елементів, що входять до складу простих чи складних речовин, утримуються разом завдяки наявності хімічного зв'язку, тобто, хімічний зв'язок - це взаємодія атомів, що зумовлює стійкість багатоатомних частинок (молекул, йонів). Утворюється за рахунок перекривання електронних орбіталей різних атомів і за рахунок взаємодії неспарених електронів цих атомів. У результаті хімічного зв'язку атоми набувають стійкого зовнішнього енергетичного рівня.
За рахунок чого він виникає? Внаслідок електростатичної взаємодії позитивно заряджених ядер і негативно заряджених електронів.
Поясніть суть електронегативності. Електронегативність - це умовна величина, яка характеризує здатність атома в хімічній сполуці притягувати до себе електрони. Електронегативність характерна для неметалічних елементів, бо атоми металічних елементів легко віддають валентні електрони і не можуть приєднати їх для добудови свого зовнішнього енергетичного рівня.
Вправа 2. Як утворюється ковалентний зв'язок? За допомогою спільних електронних пар.
Які види ковалентного зв'язку ви знаєте? Ковалентний неполярний і ковалентний полярний.
Чим вони подібні і чим відрізняються один від одного?
Подібні: обидва зв'язки утворюються за допомогою спільних електронних пар, існують між атомами неметалічних елементів.
Відрізняються: у неполярному зв'язку спільна електронна пара належить обом атомам однаковою мірою, існує між атомами з однаковою електронегативністю, а у полярному зв'язку спільна електронна пара зміщена в бік атома з більшою електронегативністю, існує між атомами з різною електронегативністю.
Відповідь проілюструйте прикладами.
| Ковалентний неполярний | Ковалентний полярний |
|
Н:Н або H—H .. .. :F:F: або F—F .. ..
:O::O: або О=О .. .. |
.. Н:F: або H—>F ..
.. H:O:H або Н—>O<—H .. |
Вправа 3. В яких речовинах існує лише неполярний зв'язок? У простих речовинах неметалів одного й того самого хімічного елемента. Чому? Бо атоми одного й того самого хімічного елемента притягують однакову кількість електронів, тобто, електронегативність одного й того самого елемента однакова, тому спільна електронна пара буде належати двом атомам в однаковій мірі.
Вправа 4. Чому молекули інертних газів, на відміну від усіх інших неметалів, у вільному стані одноатомні? В атомах інертних елементів зовнішній енергетичний рівень вже заповнений (всі електрони спарені), цим атомам просто не потрібні "чужі" електрони.
Вправа 5. Напишіть електронну і структурну формулу гідроген пероксиду Н2О2. Обчисліть скільки електронів міститься на зовнішньому енергетичному рівні атома Оксигену, число хімічних зв'язків у цій молекулі. Визначте тип кожного хімічного зв'язку.
| Електронна формула | Структурна формула |
|
.. .. Н:О:О:Н .. .. |
О Н ↗ \ ↙ Н О |
Оксиген розміщується у головній підгрупі VI групи Періодичної системи, тому на зовнішньому енергетичному рівні атома міститься 6 електронів, з них, чотири спарених і два неспарені.
Молекула пероксиду не лінійна, два зв'язки Н—О розміщені під кутом 950 із зв'язком О—О. У цій молекулі є три ковалентні хімічні зв'язки, з них, один неполярний О—О і два полярних Н→О.
Вправа 6. Намалюйте схему перекривання :
а) s-електронних хмар двох атомів;
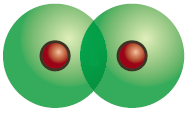
б) s-електронної хмари одного атома і р-електронної хмари іншого атома (за будь-якою з осей х,у,z).

Вправа 7. Напишіть електронні й структурні формули молекул хлору Cl2, сірководню H2S, амоніаку NH3.
| Cl2 |
H2S |
NH3 |
|
.. .. :Cl:Cl: .. ..
Cl—Cl |
.. Н:S:Н ..
Н—>S<—Н |
.. Н:N:Н Н—>N<—Н .. ↑ Н Н
|
Додаткові завдання.
Вправа 8*. Неполярні молекули у речовини:
| А HCl | Б CF4 | В NH3 | Г H2 |
Неполярний зв'язок виникає під час взаємодії атомів неметалів одного й того самого хімічного елемента, тоді спільна електронна пара належить обом атомам в однаковій мірі.
Вправа 9*. Під час утворення молекули HCl перекриваються орбіталі типу:
| А p i p | Б s i p | В s i s | Г d i p |
В утворенні ковалентного зв'язку беруть участь неспарені валентні електрони - це електрони зовнішнього енергетичного рівня. В атома Гідрогену на зовнішньому енергетичному рівні міститься один неспарений електрон на s-орбіталі, а в атома Хлору - сім електронів, з них, шість спарених і один неспарений електрон на р-орбіталі, тому хімічний зв'язок утворюється внаслідок перекривання цих орбіталей.