![]()
Початковий рівень
Вправа 1 Який ковалентний зв’язок називають:
а) полярним?
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщуються в бік одного з атомів, називають полярним.
б) неполярним?
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар розміщені симетрично відносно обох атомів, називають неполярним.
Вправа 2 Наведіть приклади сполук із полярним і неполярним ковалентним зв’язком.
Сполуки з полярним ковалентним зв'язком:
хлороводень HCl, фтороводень HF, амоніак NH3, карбон (IV) оксид CO2, Карбон (II) оксид СО та ін.
Цей тип зв'язку присутній у молекулах складних речовин, утворених неметалічними елементами з різною електронегативністю атомів.
Сполуки з неполярним ковалентним зв'язком: водень Н2, кисень О2, азот N2, озон О3, хлор Cl2, фтор F2, йод I2, бром Br2
Цей тип зв'язку присутній у молекулах простих речовин, утворених неметалічними елементами.
Середній рівень
Вправа 3 Наведіть по одному прикладу молекул з одинарним, подвійним і потрійним зв’язком.
Відповідь: HCl, O2, N2
Cтруктурні формули: 1) H—Cl, O=O, N≡N
Достатній рівень
Вправа 4 Запишіть формули речовин у порядку збільшення полярності зв’язку: H2O, CH4, HF, NH3.
Відповідь: СН4, NH3, H2O, HF
Пояснення. Чим більшою є різниця електронегативностей атомів елементів, тим полярнішим є зв'язок.
У сполуці СН4 електронегативність елементів С (2,5), Н (2,1), тому різниця 2,5-2,1=0,4
У сполуці NH3 електронегативність елементів N (3,0), H (2,1), тому різниця 3,0-2,1=0,9
У сполуці H2O електронегативність елементів H (2,1), O (3,5), тому різниця 3,5-2,1=1,4
У сполуці HF електронегативність елементів H (2,1), F (4,0), тому різниця 4,0-2,1=1,9
Високий рівень
Вправа 5 Хімічні елементи головної підгрупи VI групи утворюють з Гідрогеном молекули складу Н2Е. Як змінюється при збільшенні порядкового номера елемента: полярність зв’язку Н–Е в цих молекулах? Полярність зв'язку зменшується, бо зменшується електронегативність елементів в головній підгрупі.
Вправа 6* Які молекули називають диполями?
Диполь — це полярні молекули, у яких центри позитивного і негативного зарядів містяться у різних точках.
Вправа 7* Випишіть формули молекул-диполів: HCl, Cl2, N2, H2O.
Відповідь: H2O
Вправа 8* Визначте знак часткового заряду на атомі Хлору в молекулах HCl і ClF.
Відповідь: HClδ- і Clδ+F.
В якій із цих молекул частковий заряд Хлору більший за абсолютною величиною? ClF
Пояснення. Значення заряду δ можна вважати мірою полярності зв’язку: чим більша полярність, тим більші часткові заряди на атомах.
Чим більша є різниця електронегативностей атомів елементів, тим полярнішим є зв'язок.
У сполуці HСl електронегативність елементів H (2,1), Cl (3,0), тому різниця 3,0-2,1=0,9
У сполуці ClF електронегативність елементів H (3,0), F (4,0), тому різниця 4,0-3,0=1,0
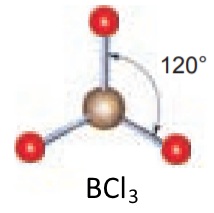
Вправа 9 Молекула BCl3 має форму рівностороннього трикутника, у вершинах якого містяться атоми Хлору, а в центрі — атом Бору. Визначте валентний кут у цій молекулі. Валентний кут 1200
Кут між зв’язками (валентний кут) — це кут між лініями, які сполучають центри атомів.