Вправа 53
Визначте відношення кількостей речовини реактантів для реакції одержання купрум (2+) оксиду з простих речовин.
Рівняння реакції: 2Сu + O2 = 2CuO
Бачимо, що 2 моль вуглецю С реагують з 1 моль кисню О2.
Відношення реактантів виглядає так: n(С):n(O2) = 2 : 1
Вправа 54
Обчисліть кількість речовини фосфор (V) оксиду, що утвориться під час реакції фосфору кількістю речовини 2 моль із киснем. Яка
кількість речовини кисню витратиться під час реакції?
Відомо: n(Р) = 2 моль
Знайти: n(Р2О5)–?, n(О2)–?
Розв'язування
Записуємо рівняння реакції: 4Р + 5О2 =2Р2О5
Відношення n(P)/n(P2O5)=4/2, звідси n(P2О5)=n(P)•2:4=2 моль•2:4 моль=1 моль
Відношення n(P)/n(O2)=4/5, звідси n(О2)=n(P)•5:4=2 моль•5:4 моль=2,5 моль
Відповідь: n(P2О5)=1 моль, n(О2)=2,5 моль.
Вправа 55
Гашене вапно Ca(OH)2 (кальцій гідроксид) використовують для зменшення кислотності ґрунтів і в будівництві. Обчисліть кількість речовини кальцій гідроксиду, що утворюється внаслідок взаємодії води з кальцій оксидом:
а) кількістю речовини 0,5 моль;
Відомо: n(СаО)=0,5 моль
Знайти: n(Са(ОН)2)–?
Розв'язування
Записуємо рівняння реакції: СаО + Н2О= Са(ОН)2
Відношення n(СаО)/n(Са(ОН)2)=1/1, звідси n(Са(ОН)2)=n(СаО)=0,5 моль
Відповідь: 0,5 моль.
б) масою 7 г.
Відомо: m(СаО)=8 г
Знайти: n(Са(ОН)2)–?
Розв'язування
Записуємо рівняння реакції: СаО + Н2О = Са(ОН)2
Обчислюємо кількість речовини кальцій оксиду СаО.
Mr(СаО)=Ar(Ca)+Ar(O)=40+16=56, тому М(СаО)=56 г/моль
n(СаO) = m(СаО)/M(CaO) = 7 г : 56 г/моль = 0,125 моль
Відношення n(Са(ОН)2)/n(СаО) = 1/1, n(Са(ОН)2) = n(СаО) = 0,125 моль
Відповідь: 0,125 моль.
Вправа 56
Запишіть рівняння реакції амоніаку NH3 із киснем з утворенням азоту N2 й води. Обчисліть масу кисню, який необхідний для спалювання амоніаку кількістю речовини 24 моль. Обчисліть маси кожного з продуктів реакції.
Відомо: n(NH3)=24 моль
Знайти: m(О2)–?, m(N2)–?, m(H2O)–?
Розв'язування
Записуємо рівняння реакції: 4NH3 + 3О2 = 2N2 + 6H2O
Відношення n(NH3)/n(О2) = 4/3, звідси n(О2)=n(NH3)•3:4 = 24 моль•3:4 = 18 моль
Обчислюємо масу кисню O2.
Mr(O2)=2Ar(O)=2•16=32, тому М(О2)=32 г/моль
m(O2) = n(О2) • M(O2) = 18 моль • 32 г/моль = 576 г
Відношення n(NH3)/n(N2) = 4/2, звідси n(N2)=n(NH3)•2:4 = 24 моль•2:4 = 12 моль
Обчислюємо масу азоту N2.
Mr(N2)=2Ar(N)=2•14=28, тому М(N2)=28 г/моль
m(N2) = n(N2) • M(N2) = 12 моль • 28 г/моль = 336 г
Відношення n(NH3)/n(H2O) = 4/6, звідси n(H2O)=n(NH3)•6:4 = 24 моль•6:4 = 36 моль
Обчислюємо масу води H2O.
Mr(H2O)=2Ar(H)+Ar(O)=2•1+16=18, тому М(H2O)=18 г/моль
m(H2O) = n(H2O) • M(H2O) = 36 моль • 18 г/моль = 648 г
Відповідь: m(O2)= 576 г, m(N2)= 336 г, m(H2O)= 648 г.
Вправа 57
Для випікання хліба й тістечок часто використовують харчовий розпушувач, який робить тісто пухким. Популярним розпушувачем є амоній гідрогенкарбонат NH4HCO3. Під час випікання він розкладається з утворенням газів: NH4HCO3 = NH3↑ + CO2↑ + H2O. Обчисліть масу такого розпушувача, необхідного для одержання вуглекислого газу кількістю речовини 0,15 моль.
Відомо: n(CO2)=0,15 моль
Знайти: m(NH4HCO3)–?
Розв'язування
Записуємо рівняння реакції: NH4HCO3 = NH3↑ + CO2↑ + H2O
Відношення n(NH4HCO3)/n(CО2) = 1/1, звідси n(NH4HCO3)=n(CО2) = 0,15 моль
Обчислюємо масу розпушувача.
Mr(NH4HCO3)=Ar(N)+5Ar(H)+Ar(C)+3Ar(O)=14+5+12+48=79, тому M(NH4HCO3)= 79 г/моль
m(NH4HCO3) = n(NH4HCO3) • M(NH4HCO3) = 0,15 моль • 79 г/моль = 11,85 г
Відповідь: m(NH4HCO3)= 11,85 г.
Вправа 58
Карбон (ІV) оксид можна одержати спалюванням (реакцією з киснем) вуглецю або метану CH4. Обчисліть, якої речовини й у скільки разів більше (за масою) необхідно для одержання вуглекислого газу масою 55 г.
Відомо: m(СO2) = 55 г
Знайти: m(С)–?, m(СН4)–?
Розв'язування
Обчислюємо кількість речовини оксиду.
Mr(CO2) = Ar(C) + 2Ar(O)=12+2•16=44, тому M(CO2)=44 г/моль.
n(CO2) = m(CO2) : M(CO2) = 55 г : 44 г/моль = 1,25 моль
Записуємо рівняння реакції спалювання вуглецю і метану:
С + О2 = СО2 (1)
СН4 + 2О2 = СО2 + 2Н2О (2)
За рівнянням (1) відношення n(С)/n(СO2)=1/1, звідси n(С)=n(СO2)=1,25 моль
Обчислюємо масу вуглецю.
Mr(C)=Ar(C)=12, тому M(C)=12 г/моль
m(C) = n(C) • M(C) = 1,25 моль • 12 г/моль = 15 г
За рівнянням (2) відношення n(СH4)/n(СO2)=1/1, звідси n(СH4)=n(СO2)=1,25 моль
Обчислюємо масу метану.
Mr(CH4)=Ar(C)+4Ar(H)=12+4•1=16, тому M(CH4)=16 г/моль
m(CH4) = n(CH4) • M(CH4) = 1,25 моль • 16 г/моль = 20 г
Визначимо у скільки разів більше необхідно маси метану, ніж маси вуглецю:
m(CH4):m(C) = 20 г : 15 г = 1,33 рази
Відповідь: у 1,33 рази більше необхідно метану (за масою), ніж вуглецю.
Вправа 59
У сільському господарстві широко використовують амоніачну селітру як азотне добриво. За нагрівання така селітра розкладається. Обчисліть масу амоніачної селітри, необхідної для одержання нітроген (І) оксиду масою 5 г.
Відомо: m(N2O) = 5 г
Знайти: m(NH4NO3)–?
Розв'язування
Записуємо рівняння реакції: NH4NO3 = N2O + 2H2O
Обчислюємо кількість речовини нітроген (I) оксиду.
Mr(N2O) = 2Ar(N) + Ar(O) = 2•14 + 16 = 44, тому M(N2O)=44 г/моль
n(N2O) = m(N2O) : M(N2O) = 5 г : 44 г/моль = 0,114 моль
Відношення n(NH4NO3)/n(N2O)= 1/1, звідси n(NH4NO3)=n(N2O)= 0,114 моль
Обчислюємо масу амоніачної селітри.
Mr(NH4NO3)= 2Ar(N) +4Ar(H)+ 3Ar(O) = 2•14 + 4•1 + 3•16 = 80, тому M(NH4NO3)= 80 г/моль
m(NH4NO3) = n(NH4NO3) • M(NH4NO3) = 0,114 моль • 80 г/моль = 9,12 г
Відповідь: m(NH4NO3) = 9,12 г.
Вправа 60
Для знезараження води на водоочисних спорудах часто використовують натрій гіпохлорит NaClO. У воді він може розкладатися з утворенням натрій хлориду та кисню. Запишіть хімічне рівняння цієї реакції та обчисліть масу натрій хлориду, який залишиться у воді, у разі використання натрій гіпохлориту масою 5 кг.
Відомо: m(NaClO) = 5 кг = 5000 г
Знайти: m(NaCl)–?
Розв'язування
Записуємо рівняння реакції: 2NaClO = 2NaCl + O2
Обчислюємо кількість речовини гіпохлориту.
Mr(NaClO) = Ar(Na) + Ar(Cl) + Ar(O) = 23 + 35,5 + 16 = 74,5, тому M(NaClO)=74,5 г/моль.
n(NaClO) = m(NaClO) : M(NaClO) = 5000 г : 74,5 г/моль = 67,1 моль
Відношення n(NaClO)/n(NaCl)= 2/2 = 1/1, звідси n(NaCl)=n(NaClO)= 67,1 моль
Обчислюємо масу натрій хлориду.
Mr(NaCl)= Ar(Na) + Ar(Cl) = 23 + 35,5 = 58,5, тому M(NaCl)= 58,5 г/моль
m(NaCl) = n(NaCl) • M(NaCl) = 67,1 моль • 58,5 г/моль = 3925 г = 3,9 кг.
Відповідь: m(NaCl) = 3920 г.
Вправа 61
Для зварювання рейок на залізниці часто використовують термітну суміш — суміш алюмінію з ферум (3+) оксидом. За нагрівання суміші утворюються залізо й алюміній оксид. Запишіть хімічне рівняння цієї реакції та обчисліть масу заліза, яке можна одержати з ферум (3+) оксиду масою 54 г.
Відомо: m(Fe2O3) = 54 г
Знайти: m(Fe)–?
Розв'язування
Записуємо рівняння реакції: 2Al + Fe2O3 = 2Fe + Al2O3
Обчислюємо кількість речовини оксиду.
Mr(Fe2O3)=2Ar(Fe)+3Ar(O)=2•56+3•16=160, тому M(Fe2O3)=160 г/моль.
n(Fe2O3) = m(Fe2O3) : M(Fe2O3) = 54 г : 160 г/моль = 0,3375 моль
Відношення n(Fe2O3)/n(Fe)= 1/2, звідси n(Fe)=n(Fe2O3)•2=0,3375 моль • 2 = 0,675 моль
Обчислюємо масу заліза.
Mr(Fe)=Ar(Fe)=56, тому M(Fe)= 56 г/моль
m(Fe) = n(Fe) • M(Fe) = 0,675 моль • 56 г/моль = 37,8 г
Відповідь: m(Fe) = 37,8 г.
Вправа 62
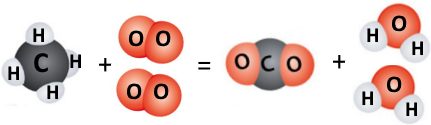
Створіть модель реакції горіння метану СН4 подібно до того, як це зроблено в цьому параграфі.
CH4 + 2O2 = CO2 + 2H2O
n(CH4)/1 + n(O2)/2 = n(CO2)/1 + n(H2O)/2
Метан кількістю речовини 1 моль реагує з киснем кількістю речовини 2 моль, при цьому утворюється вуглекислий газ кількістю речовини 1 моль і вода кількістю речовини 2 моль.
Вправа 63
У яких кількісних відношеннях слід змішати залізо із сіркою для одержання ферум (2+) сульфіду? Обчисліть маси реактантів, які необхідні для одержання ферум (2+) сульфіду кількістю речовини 1 моль.
Відомо: n(FeS) = 1 моль
Знайти: m(Fe)–?, (S)–?
Розв'язування
Записуємо рівняння реакції:
Fe + S = FeS
Відношення n(Fe)/1=n(S)/1=n(FeS)/1, звідси n(Fe)=n(S)=n(FeS)=1 моль
Обчислюємо маси заліза і сірки.
Mr(Fe)= Ar(Fe) = 56, тому M(Fe)= 56 г/моль
m(Fe) = n(Fe) • M(Fe) = 1 моль • 56 г/моль = 56 г
Mr(S)= Ar(S) = 32, тому M(S)= 32 г/моль
m(S) = n(S) • M(S) = 1 моль • 32 г/моль = 32 г
Відповідь: m(Fe) = 56 г, m(S) = 32 г.